Способы выражения состава раствора
Состав раствора выражается различными способами:
а) в виде долей или процентов.
Массовая доля Wi и массовый процент Wi (%)
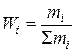
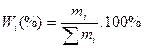
где 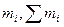 - масса i-го компонента и масса всего раствора.
- масса i-го компонента и масса всего раствора.
Объемная доля 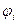 и объемный процент
и объемный процент 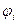 ,(%)
,(%)

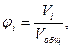
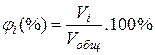
где Vi, Vобш – объем i-гo компонента и общий объем раствора.
Молярная доля Xi и молярный процент Xi(%)
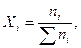
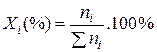
где 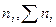 - количество i-гo компонента и общее количество всех компонентов раствора.
- количество i-гo компонента и общее количество всех компонентов раствора.
б) Молярная концентрация, С, моль/м3 ; моль/л - это количество вещества в единице объема раствора:
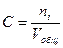
Примеры обозначения: С(Н2SO4)= 0,1 моль/л; C(NH4+)=20 моль/л;
в) молярная концентрация эквивалента (нормальность) - то же,
что и молярная концентрация, но в качестве структурной единицы взят
эквивалент.
Пример обозначения: С( 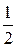 Н2SO4) =0,1 моль/л;
Н2SO4) =0,1 моль/л;
г) массовая концентрация масса данного вещества в единице объема раствора (не путать с плотностью):
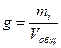 ; кг/м3;
; кг/м3; 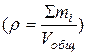
д) моляльность - количество вещества в 1 кг растворителя:
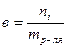
Пример обозначения: в(H2S04 I H20)= 0,1 моль/кг. Часто в литературе моляльность обозначается "m". Однако, согласно ГОСТ 8.417-81, моляльность (в отличие от массы) должна обозначаться в.
3.2 Закон Рауля. Идеальные растворы
Свойства растворов являются сложной функцией состава, температуры, давления и в значительной мере определяются характером межмолекулярных взаимодействий, главным образом, соотношением энергий взаимодействия между одно- и разнородными частицами 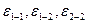 . Предсказать свойства растворов, зная их состав и свойства компонентов, удается лишь для простейших случаев - идеальных растворов. Они получаются из веществ с одинаковыми размерами молекул и энергиями межчастичных взаимодействий:
. Предсказать свойства растворов, зная их состав и свойства компонентов, удается лишь для простейших случаев - идеальных растворов. Они получаются из веществ с одинаковыми размерами молекул и энергиями межчастичных взаимодействий:
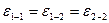
При этом смешение не сопровождается тепловым эффектом, DНсмеш =0, изменением объема при смешении 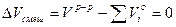 ;
; 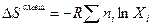
При анализе результатов измерений давления насыщенного пара растворов нелетучих веществ Ф. Рауль обнаружил, что парциальное давление растворителя над раствором пропорционально его молярной доле в растворе;
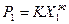
где К - коэффициент пропорциональности, равный 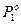 - давлению чистого растворителя.
- давлению чистого растворителя.
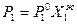
 (3.26)
(3.26)
Эта закономерность получила название закона Рауля.
Растворы, в которых оба компонента летучи и каждый из них подчиняется закону Рауля, являются идеальными.
Линейная зависимость парциальных давлений от состава приводят к линейной зависимости и общего давления от состава (рис.2). Так, для системы А - В:
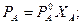
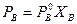 ;
; 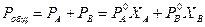
Поскольку ХА + Хв = 1,
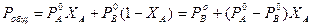
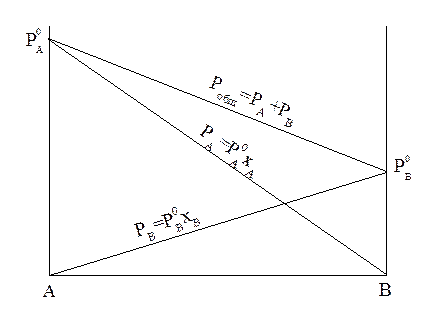
Рисунок - Зависимость парциальных и общего давления паров от состава идеального раствора
Часто закон Рауля используется в виде уравнения:

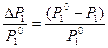 (3.27)
(3.27)
что отвечает формулировке: относительное понижение давления пара растворителя над раствором равно молярной доле растворенного вещества.
3.3 Следствия из закона Рауля
По закону Рауля давление растворителя над раствором всегда ниже, чем над чистым растворителем, 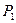 <
< 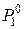 . Это приводит к повышению температуры кипения раствора и понижению температуры замерзания растворителя из раствора нелетучего компонента по сравнению с соответствующими температурами для чистого растворителя.
. Это приводит к повышению температуры кипения раствора и понижению температуры замерзания растворителя из раствора нелетучего компонента по сравнению с соответствующими температурами для чистого растворителя.
Дата добавления: 2016-06-22; просмотров: 2787;











