Отклонения от закона Рауля
В реальных растворах закон Рауля применим для растворителя лишь в бесконечно разбавленных растворах. В более концентрированных растворах за счет сил межмолекулярного взаимодействия наблюдаются отклонения от закона Рауля.
а) положительные отклонения.
Если 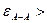
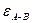 ;
; 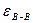 >
> 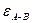 , т.е. силы взаимодействия между однородными молекулами больше, чем между разнородными, то
, т.е. силы взаимодействия между однородными молекулами больше, чем между разнородными, то 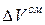 >0 (объем увеличивается), а
>0 (объем увеличивается), а 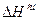 >0 (тепло поглощается). При этом за счет ослабления сил взаимодействия выход молекул, в паровую фазу облегчается и давление пара над реальным раствором становится больше, чем над идеальным.
>0 (тепло поглощается). При этом за счет ослабления сил взаимодействия выход молекул, в паровую фазу облегчается и давление пара над реальным раствором становится больше, чем над идеальным.
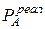 >
> 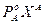 ;
; 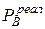 >
> 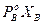
Положительные отклонения наблюдаются в системах этанол -диэтиловый эфир; бензол - ацетон; кислород - азот и др.
б) отрицательные отклонения от идеального поведения характерны для растворов, компоненты которых взаимодействуют друг с другом сильнее, чем однородные молекулы, т.е.
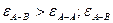 >
> 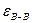
При этом возникают водородные связи, происходит сольватация, а иногда образуются химические соединения. Теплота при смешении выделяется, 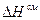 <0; объем при смешении уменьшается,
<0; объем при смешении уменьшается, 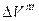 <0; выход молекул в пар затрудняется и
<0; выход молекул в пар затрудняется и 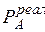 <
< 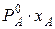
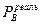 <
< 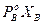 .
.
Такие отклонения наблюдаются в системах хлороформ - бензол; вода -серная кислота и др.

| 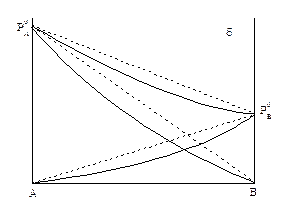
|
Рис. 4. Зависимость давления пара от состава в реальных системах
а) положительные отклонения; б) отрицательные отклонения от закона Рауля
Иногда при одних соотношениях компонентов в растворе наблюдаются положительные отклонения, при других - отрицательные. Пример - раствор пиридина в воде (рис.5).
Зависимость общего давления от состава жидкости в системах с отклонениями от закона Рауля будет также нелинейной (рис.4).
В системах, со значительными отклонениями от закона Рауля на диаграмме Робщ = f(Xж) возможно появление экстремума (минимума или максимума). Экстремум может появиться и при небольшом отклонении от идеального поведения, если давление пара над чистыми компонентами мало отличаются друг от друга, т.е. 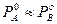 (рис.6).
(рис.6).
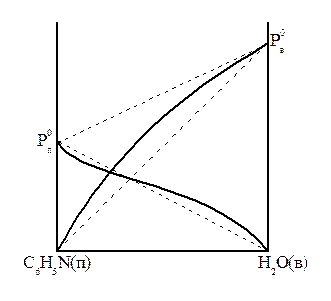
Рисунок 5 – Давление в системе пиридин – вода.
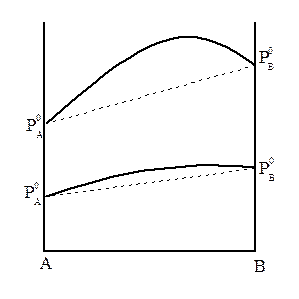
Рисунок 6 – Кривые общего давления с максимумом.
3.4.2 Активность. Коэффициент активности
Льюис предложил для реальных систем сохранить тот же вид термодинамических уравнений, что и для идеальных, заменяя в них переменную, выражающую состав, на другую — активность.
Химический потенциал компонента идеального раствора выражается уравнением
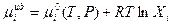 (3.28)
(3.28)
Для неидеальных систем
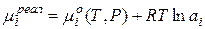
где аi - активность компонента i; 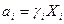 ,
,
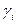 - коэффициент активности.
- коэффициент активности.
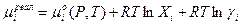 (3.29)
(3.29)
Введение активности и коэффициента активности позволяет наиболее просто сопоставлять между собой свойства реальной и идеальной систем.
Из уравнений (3) и (4) видно, что химический потенциал реальной системы отличается от идеальной на величину:
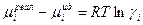
Изменение химического потенциала есть работа при переходе одного моля компонента из идеального раствора в реальный при Р, Т= const. Значения 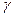 отражают особенности межмолекулярных взаимодействий, различия в свойствах компонентов раствора. Чем ближе раствор по свойствам к идеальному, тем ближе значение g к единице. В идеальном растворе по закону Рауля:
отражают особенности межмолекулярных взаимодействий, различия в свойствах компонентов раствора. Чем ближе раствор по свойствам к идеальному, тем ближе значение g к единице. В идеальном растворе по закону Рауля:
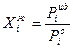
В реальном вместо 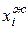 - активность,
- активность, 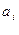 ,
, 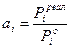 отсюда
отсюда 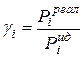
При положительном отклонении 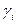 > 1, при отрицательном -
> 1, при отрицательном - 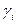 < 1.
< 1.
Дата добавления: 2016-06-22; просмотров: 5862;











