Понижение температуры замерзания раствора
При кристаллизации чистого растворителя в равновесии находятся три фазы:
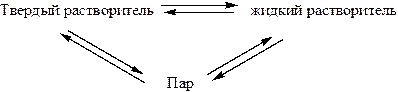
При кристаллизации растворителя из раствора:
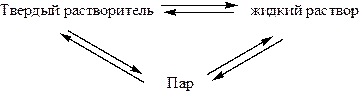
Условием равновесия фаз является равенство химических потенциалов вещества в различных фазах:
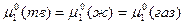
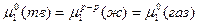
При этом в первом случае давление пара над чистым твердым и чистым жидким растворителем будет одним и тем же, 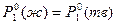 . (точка О, рис.3). Это равенство наступает при температуре
. (точка О, рис.3). Это равенство наступает при температуре 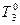 . Во втором же случае равенство давлений и равновесие двух фаз достигается при более низкой температуре, чем температура замерзания чистого растворителя (
. Во втором же случае равенство давлений и равновесие двух фаз достигается при более низкой температуре, чем температура замерзания чистого растворителя ( 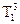
 и
и 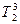 рис.3). Это понижение зависит от концентрации раствора:
рис.3). Это понижение зависит от концентрации раствора:
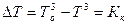 .в
.в
где в - моляльность раствора;
Кк - криоскопическая постоянная, равная понижению температуры замерзания растворителя при кристаллизации его из одномоляльного раствора неэлектролита:
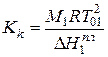
Где М1, Т01 и 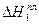 соответственно молярная масса, кг/моль; температура,К и молярная теплота плавления растворителя, Дж/моль.
соответственно молярная масса, кг/моль; температура,К и молярная теплота плавления растворителя, Дж/моль.
Значения Кэ и Кк - табличные данные.
В случае растворов электролитов число растворенных частиц увеличивается за счет диссоциации, давление пара понижается, понижается и температура замерзания, т.е. DТнэ <DTэл
Реальные растворы
Дата добавления: 2016-06-22; просмотров: 2328;











