Равновесие между конденсированными и газообразными фазами
Это равновесие типа кристаллы  пар; жидкость
пар; жидкость  пар. Для этих фазовых равновесий
пар. Для этих фазовых равновесий  всегда положительны, так как ΔН > 0 и ΔV > 0. Это значит, что нагревание системы всегда вызовет увеличение давления насыщенного пара, а повышение внешнего давления приведет к повышению температуры кипения (линии ОВ и ОС на рисунке 2.1).
всегда положительны, так как ΔН > 0 и ΔV > 0. Это значит, что нагревание системы всегда вызовет увеличение давления насыщенного пара, а повышение внешнего давления приведет к повышению температуры кипения (линии ОВ и ОС на рисунке 2.1).
Приведем уравнение 2.1 к виду более удобному для практического применения. Используем два приближения:
1. При температурах, далеких от критической, Vпар>>Vж; Vпар>>Vтв.; ΔV ≈ Vпар.
2. Вдали от критической температуры насыщенный пар подчиняется уравнению состояния идеальных газов
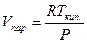 ,
,
Тогда уравнение (2.1) преобразуется следующим образом:
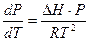 , или
, или 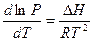 (2.4)
(2.4)
Интегрирование этого уравнения при 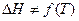 дает линейную зависимость lnP от
дает линейную зависимость lnP от 
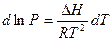
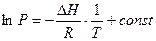 (2.5)
(2.5)
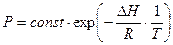


Рисунок 2.2 – зависимость давления насыщенного пара от температуры в координатах (ln P;1/Т)

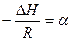 - тангенс угла наклона прямой к оси абцисс:
- тангенс угла наклона прямой к оси абцисс:
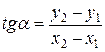 ,
,
где (y2; х2), (y1; х1) – координаты двух точек, лежащих на прямой.
Точки (не обязательно экспериментальные) выбирать отстоящими подальше друг от друга.
Коэффициент «b» из графика найти невозможно, если в начале координат не 0. Поэтому найти «b» можно из уравнения для какой-либо точки, лежащей на прямой. Определив «а», найти теплоту испарения:
ΔН = - Rtgα,
где R=8,31 Дж/моль·К.
Интегрирование уравнения в определенных пределах приводит к уравнению:
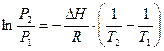 (2.6)
(2.6)
по которому можно рассчитать теплоту испарения по двум экспериментальным значениям давлений и температур.
Согласно эмпирическому правилу Трутона молярная энтропия испарения при нормальной температуре кипения для многих жидкостей постоянна и равна:
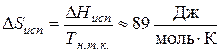
где Тн.т.к. – нормальная температура кипения при Р = 1 атм.
Для полярных жидкостей с сильными межмолекулярными взаимодействиями ΔSисп. превышает данную величину. Например, для воды она равна 109 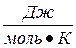 .
.
2.3 Примеры решения задач.
Задача 1
Зависимость температуры плавления нафталина от давления выражается уравнением: tпл = 80,10 + 0,0371×10-5P(Па) – 186,99×10-18Р2 (Па).
Рассчитать изменение объема при плавлении 1 кг нафталина при Р = 1 атм, если его теплота плавления равна 138,6 Дж/кг.
Дано:
mнафт. = 1 кг
DНпл. = 138,6 Дж/г
Р = 1 атм = 1,0133×105 Па
DVпл. - ?
Решение:

Для фазовых переходов конденсированных фаз применяется уравнение: 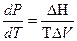 .
.
Определим сначала производную  . Так как Т = t + 273,15;
. Так как Т = t + 273,15; 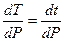 ;
;
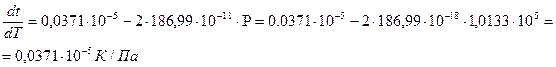
Откуда 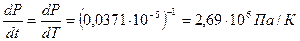
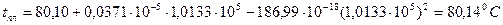
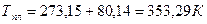
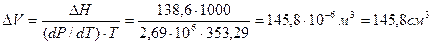
Задача 2
Давление пара хлороформа при 50 0С равно 535 мм. рт. ст., теплота испарения хлороформа 30,836 кДж/моль. Определить нормальную температуру кипения хлороформа.
Дано:
T1=50 0C = 323 К
Р1 = 535 мм. рт. ст.
Р2 = 1 атм. = 760 мм.рт.ст.
DНисп. = 30,836 кДж/моль
Т2 кип. - ?
Решение:
Нормальная температура кипения (н.т.к.) – температура кипения при Р = 1 атм.
Для решения используется уравнение для фазового перехода с участием газов:
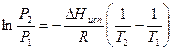
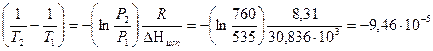
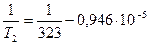
Т2 = 333 К
Примечание. В данной задаче теплота испарения в данном температурном интервале принята постоянной, поэтому было использовано уравнение для DН = соnst.
Если же DНисп. = f (Т), то надо использовать дифференциальное уравнение для нахождения DНисп или DНвозг. Поскольку зависимости lnP=f(T) и lnKP=f(T) аналогичны, предлагаем обратиться к решению задачи № 3 на странице 42.
2.4 Двухкомпонентные системы
Дата добавления: 2016-06-22; просмотров: 3746;











