Тема 2.3. «Уравнение состояния идеального газа».
Содержание учебного материала: «Уравнение состояния идеального газа. Изопроцессы. Газовые законы.»
Цели.
Учебные:
Сформировать специальные знания, умения и навыки по заданной теме.
Раскрыть сущность уравнения Менделеева – Клайперона, изопроцессов и газовых законов.
Научить строить графики изопроцессов.
Научить применять газовые законы при решении практических и графических задач.
Воспитательные:
Воспитывать трудолюбие, интерес к предмету, внимательность и наблюдательность.
Прививать навыки работы в должном темпе, развивать инициативу, уверенность в своих силах.
Повысить интерес обучающихся к изучаемому материалу путем разнообразия форм проведения уроков.
Развивающие:
Развивать познавательные способности обучающихся.
Активизировать исследовательские способности.
Расширять их кругозор, исследовательское мышление.
Уметь применять полученные теоретические знания на практике.
Развить умения слушать, анализировать, чётко аргументировать , излагать и отстаивать своё мнение.
Оборудование:манометр, термометр, весы, нагреватель, ёмкость для нагревания жидкости, градуированный сосуд, секундомер, измерительная лента.
Берём формулу 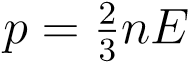 и подставляем в неё
и подставляем в неё 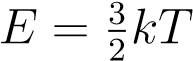 . Получаем:
. Получаем:
p = nkT.
Вспомним теперь, что 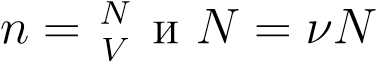 A, где ν — число молей газа:
A, где ν — число молей газа:
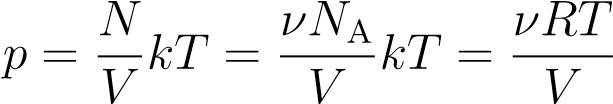 ,
,
откуда
pV= νRT. (3)
Соотношение (3) называется уравнением Менделеева — Клапейрона. Оно даёт взаимосвязь трёх важнейших макроскопических параметров, описывающих состояние идеального газа — давления, объёма и температуры. Поэтому уравнение Менделеева — Клапейрона называется ещё уравнением состояния идеального газа.
Учитывая, что 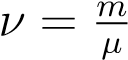 , где m — масса газа, получим другую форму уравнения Менделеева — Клапейрона:
, где m — масса газа, получим другую форму уравнения Менделеева — Клапейрона:
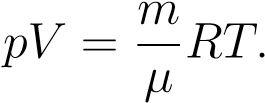 (4)
(4)
Есть ещё один полезный вариант этого уравнения. Поделим обе части на V :
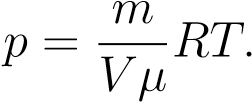
Но 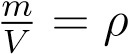 — плотность газа. Отсюда
— плотность газа. Отсюда
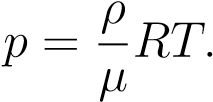 (5)
(5)
В задачах по физике активно используются все три формы записи (3)—(5).
На протяжении этого раздела мы будем придерживаться следующего предположения: масса и химический состав газа остаются неизменными. Иными словами, мы считаем, что:
m = const, то есть нет утечки газа из сосуда или, наоборот, притока газа в сосуд;
µ = const, то есть частицы газа не испытывают каких-либо изменений (скажем, отсутствует диссоциация — распад молекул на атомы).
Эти два условия выполняются в очень многих физически интересных ситуациях (например, в простых моделях тепловых двигателей) и потому вполне заслуживают отдельного рассмотрения.
Если масса газа и его молярная масса фиксированы, то состояние газа определяется тремя макроскопическими параметрами: давлением, объёмом и температурой. Эти параметры связаны друг с другом уравнением состояния (уравнением Менделеева — Клапейрона).
Дата добавления: 2020-04-12; просмотров: 818;











