Химические свойства
Фосфин сильно отличается от его аналога аммиака. Его химическая активность выше, чем у аммиака, он плохо растворим в воде, как основание значительно слабее аммиака. Последнее объясняется тем, что связи H-P поляризованы слабо и активность неподелённой пары электронов у фосфора (3s2) ниже, чем у азота (2s2) в аммиаке.
В отсутствие кислорода при нагревании разлагается на элементы:
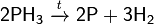
на воздухе самопроизвольно воспламеняется (в присутствии паров дифосфина или при температуре свыше 100 °C):
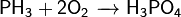
Проявляет сильные восстановительные свойства:
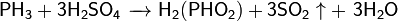
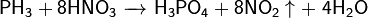
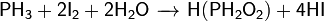
При взаимодействии с сильными донорами протонов фосфин может давать соли фосфония, содержащие ион PH4+ (аналогично аммонию). Соли фосфония, бесцветные кристаллические вещества, крайне неустойчивы, легко гидролизуется.
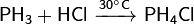
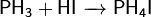
Соли фосфина, как и сам фосфин, являются сильными восстановителями.
Токсичность
Фосфин сильно ядовит, действует на нервную систему, нарушает обмен веществ. ПДК = 0,1 мг/м³. Запах ощущается при концентрации 2-4 мг/м³, длительное вдыхание при концентрации 10 мг/м³ приводит к летальному исходу. В крови человека содержание фосфина не более 0,001 мг/м³.
Известны следующие оксиды фосфора:
| Название | Формула | Температура плавления | Температура кипения |
| Оксид тетрафосфора | P4O | ||
| Диоксид тетрафосфора | P4O2 | ||
| Оксид фосфора(III) | P2O3 (P4O6) | 23,8 °C | 173,5 °C |
| Оксид фосфора(IV) | P4O8 | ||
| Оксид фосфора(V) | P2O5 (P4O10) | 569 °C | 591 °C |
Оксид фосфора(III) — бинарное неорганическое соединение, оксид фосфора с формулой P4O6, белые хлопья или кристаллы с неприятным запахом, реагируют с водой.
Получение
· Осторожной окисление белого фосфора закисью азота или углекислотой:
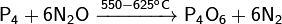
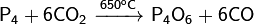
· Обратное диспропорционирование оксида фосфора(V) и белого фосфора:
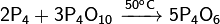
[править]Физические свойства
Оксид фосфора(III) образует белые хлопья или кристаллы с неприятным запахом.
Хорошо растворяется в органических растворителях (бензол, сероуглерод).
Неустойчив на свету, вначале желтеет, а затем краснеет.
[править]Химические свойства
· На свету или при нагревании в вакууме разлагается с выделением красного фосфора:
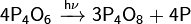
· Медленно реагирует с холодной водой:
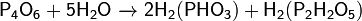
· и быстро с горячей водой:
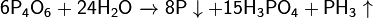
· Реагирует с щелочами:
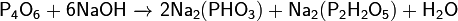
· Окисляется кислородом воздуха (быстрее при нагревании):
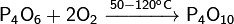
· Реагирует с галогенами:
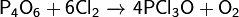
· Реагирует с серой:
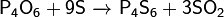
Оксид фосфора(V)
Пентаокс́ид фосфора (фо́сфорный ангидрид, пятиокись фосфора, оксид фосфора(V)) — P4O10, кислотный оксид.
Свойства
P4O10 очень активно взаимодействует с водой (H-форма поглощает воду даже со взрывом), образуя смеси фосфорных кислот, состав которых зависит от количества воды и других условий:
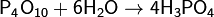
Он также способен извлекать воду из других соединений, представляя собой сильное дегидратирующее средство:
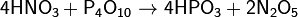
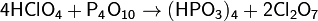
Оксид фосфора(V) широко применяется в органическом синтезе. Он реагирует с амидами, превращая их в нитрилы:
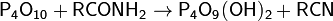
Карбоновые кислоты переводит в соответствующие ангидриды:
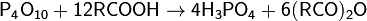
Оксид фосфора(V) также взаимодействует со спиртами, эфирами, фенолами и другими органическими соединениями. При этом происходит разрыв связей P—О—P и образуются фосфорорганические соединения. Реагирует с NH3 и с галогеноводородами, образуя фосфаты аммония и оксигалогениды фосфора:
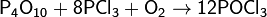
При сплавлении P4O10 с основными оксидами образует различные твёрдые фосфаты, природа которых зависит от условий реакции.
Получение
Оксид фосфора(V) получают сжиганием фосфора. Технологический процесс происходит в камере сжигания и включает в себя окисление элементарного P предварительно осушенным воздухом, осаждение P4O10 и очистку отходящих газов. Очищают полученный пентаоксид возгонкой.
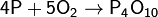
Технический продукт имеет вид белой снегообразной массы, состоящей из смеси разных форм P4O10.
Применение
P4O10 применяют как осушитель газов и жидкостей. Также он является промежуточным продуктом в производстве ортофосфорной кислоты H3PO4термическим способом.
Широко используется в органическом синтезе в реакциях дегидратации и конденсации.
Значение фосфора
· фосфор входит в состав нуклеиновых кислот, которые принимают участие в процессах роста, деления клеток, хранения и использования генетической информации
· фосфор содержится в составе костей скелета (около 85% от общего количества фосфора организма)
· фосфор необходим для нормальной структуры зубов и десен
· обеспечивает правильную работу сердца и почек
· фосфор участвует в процессах накопления и освобождения энергии в клетках
· участвует в передаче нервных импульсов
· помогает обмену жиров и крахмалов.
Неорганический элемент фосфор, Р, находится в организме человека в виде соединений фосфора — неорганических фосфатов и липидов или нуклеотидов.
Содержание фосфора в организме регулирует паратгормон, кальцитонин и витамин Д.
Дата добавления: 2016-06-22; просмотров: 5133;











