Основные положения теории электролитической диссоциации. Механизм электролитической диссоциации. Степень и константа диссоциации.
Электролиты –вещества, которые при растворении подвергаются диссоциации на ионы. В результате раствор приобретает способность проводить электрический ток, т.к. в нем появляются подвижные носители электрического заряда. Например, при растворении в воде уксусная кислота диссоциирует на ион водорода и ацетат-ион:
CH3COOH  H+ + CH3COO–
H+ + CH3COO–
Необходимым условием, определяющим возможность процесса электролитической диссоциации, является наличие в растворяемом веществе ионных * или полярных связей *, а также достаточная полярность * самого растворителя *. Количественная оценка процесса электролитической диссоциации дается двумя величинами: степенью диссоциации α и константой диссоциации K.
Степенью диссоциации (α) электролита называется отношение числа его молекул, распавшихся на ионы, к общему числу молекул электролита в растворе, т. е. 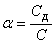 . Так, если C=0,1 моль/л, а концентрация диссоциированной части вещества Сд=0,001 моль/л, то для растворенного вещества α=0,001/0,1=0,01, или α=1%. Степень электролитической диссоциации зависит как от природы растворенного вещества, так и от концентрации раствора, увеличиваясь с его разбавлением.
. Так, если C=0,1 моль/л, а концентрация диссоциированной части вещества Сд=0,001 моль/л, то для растворенного вещества α=0,001/0,1=0,01, или α=1%. Степень электролитической диссоциации зависит как от природы растворенного вещества, так и от концентрации раствора, увеличиваясь с его разбавлением.
Электролиты можно разделить на две большие группы: сильные и слабые. Сильные электролиты диссоциируют практически полностью. К сильным электролитам относятся, например, H2SO4, HCl, HNO3, H3PO4, HClO3, HClO4, KOH, а также хорошо растворимые соли: NaCl, KBr, NH4NO3 и др. Для слабых электролитов устанавливается равновесие между недиссоциированными молекулами и ионами. К слабым электролитам относятся плохо растворимые соли, вода и большинство органических кислот (например, уксусная CH3COOH, муравьиная HCOOH), а также неорганические соединения: H2CO3, H2S, HCN, H2SiO3, H2SO3, HNO2, HClO, HCNO, NH4OH и др.
Константа равновесия для процесса диссоциации называется константой диссоциации (K). В общем случае для электролита,диссоциирующего на два иона:
АВ  А+ + В–;
А+ + В–; 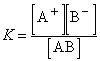
Для приведенного выше процесса диссоциации уксусной кислоты:
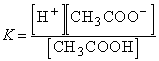
Если обозначить концентрацию электролита, распадающегося на два иона, через C, то
[A+] = [B–] = αC; [AB] = C(1–α); 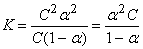
Степень диссоциации возрастает с разбавлением раствора.
Многоосновные кислоты, а также основания многовалентных металлов диссоциируют ступенчато. Например:
1Ст. H2CO3  H+ + HCO3– 2Ст.HCO3–
H+ + HCO3– 2Ст.HCO3–  H+ + CO32–
H+ + CO32–
Первое равновесие – диссоциация по первой ступени – характеризуется константой
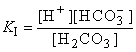 Для диссоциации по второй ступени:
Для диссоциации по второй ступени: 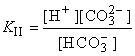
Дата добавления: 2016-06-22; просмотров: 2155;











