Решение типовых задач
Пример 1. Выяснить, в какую сторону пойдет реакция между двуокисью свинца и иодидом калия в кислой среде, если концентрация веществ (активность) равна 1 моль/л.
Решение. 1) составляем уравнение:
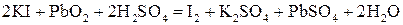 ;
;
2) пишем схему элемента для данной реакции:
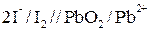 ;
;
3) находим окислительно-восстановительные потенциалы и ЭДС реакции:
 ,
, 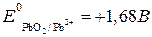 .
.
Поскольку потенциал второй пары больше, чем первой, роль окислителя будет играть 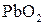 .
.
 .
.
Делаем вывод, что вышеуказанная реакция возможна, так как ЭДС является величиной положительной (идет она слева направо с напряжением 1,15 В).
Пример 2. Определить, какой из металлов – барий или никель, лучше взаимодействует с разбавленной соляной кислотой.
Решение.
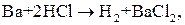
 ,
,
 В,
В,
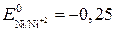 В,
В,
ЭДС(1) = 0,00 – ( - 2,90) = 2,90 В,
ЭДС(2) = 0,00 – ( - 0,25) = 0,25 В.
ЭДС первой реакции в несколько раз больше, чем второй. Барий будет взаимодействовать с соляной кислотой более интенсивно, чем никель.
Пример 3. Может ли перманганат калия окислить хлорид олова (II), если концентрация их растворов (активность) равна 1 моль/л?
Решение. Составляем уравнение реакции:
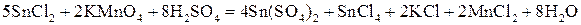 .
.
Находим потенциалы пар:
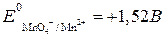 ,
,
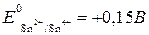 .
.
Вычисляем ЭДС реакции:
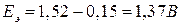 .
.
Устанавливаем, что  в кислой среде может окислить
в кислой среде может окислить 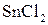 , так как ЭДС реакции положительная и приведенная выше реакция возможна.
, так как ЭДС реакции положительная и приведенная выше реакция возможна.
Пример 4. Какова масса меди, выделившейся на электроде при прохождении через электрохимическую систему количества электричества 2F и выходе меди по току, равном единице (100%)?
Решение. Согласно законам Фарадея, при похождении количества электричества, равного 2F, выделится 2 моль эквивалента меди, что составляет:
MCu = MэCu · 2 = (63,57/2) г/моль · 2 моль = 63,57 г.
Пример 5. Определите выход по току водорода, выделенного на электроде при нормальных условиях, если объем его составил 112 л при прохождении через электрод 1000А · ч.
Решение. Объем моль эквивалента водорода при н.у. составляет
22,4/2 = 11,2 л. Для выделения такого объема водорода требуется количество электричества, равное 1F, или 26,8 А · ч. Следовательно, для выделения 112 л требуется 268 А · ч. Найдем выход по току водорода:
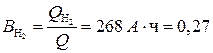 или (27%).
или (27%).
Пример 6. Вычислить электродный потенциал цинка в растворе 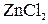 , в котором активность ионов
, в котором активность ионов 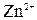 составляет 7
составляет 7 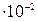 г-ион/л.
г-ион/л.
Решение.
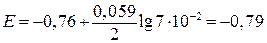 В.
В.
Э.д.с. гальванического элемента при различной активности концентрации катионов металла в растворе равна разности равновесных электродных потенциалов этих металлов. При этом, как и в случае стандартных потенциалов, следует при вычитании придерживаться условия, приведенного выше. Так, э.д.с. медно-цинкового электрода равна разности 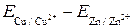 , а после замены
, а после замены
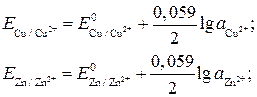
получим выражение
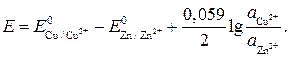 (6.1)
(6.1)
Пользуясь уравнением (6.1), можно вычислить э.д.с. любой гальванической пары при условии образования обоими металлами катионов с одинаковым зарядом п. При различном значении п следует раздельно вычислить равновесные электродные потенциалы металлов и затем найти их разность.
Анализ уравнения (6.1) приводит к выводу, что при одинаковом значении п обоих металлов и при равенстве их активностей  э.д.с. гальванического элемента равна разности стандартных потенциалов.
э.д.с. гальванического элемента равна разности стандартных потенциалов.
Гальванические элементы и соответствующие им полуэлементы условно изображаются следующей записью, например
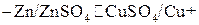
или в ионной форме
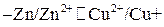 ,
,
в которой одиночные вертикальные линии символизируют границу металл – раствор, а двойная – границы между обоими растворами электролитов.
Пример 7. Вычислить ЭДС медно-кадмиевого гальванического элемента, в которой активность ионов 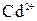 составляет 0,8 моль/л, а ионов
составляет 0,8 моль/л, а ионов 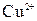 - 0,01 моль/л.
- 0,01 моль/л.
Решение. Для решения воспользуемся уравнением (6.1)
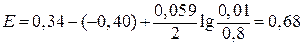 В.
В.
Пример 8. Вычислить ЭДС серебряно-кадмиевого гальванического элемента, в котором активные концентрации ионов  и
и 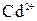 соответственно составляют 0,1 и 0,005 моль/л.
соответственно составляют 0,1 и 0,005 моль/л.
Решение. Потенциалы отдельных электродов составляют:
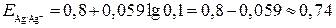 В,
В,
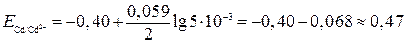 В.
В.
отсюда
Е = 0,74 – ( - 0,47) = 1,21 В.
Пример 9. Гальванические элементы могут быть получены не только из двух различных электродов, но и из двух одинаковых. Однако в этом случае они должны быть помещены в растворы с различной активностью катиона. При этом металлический электрод, помещенный в более разбавленный раствор, выполняет функцию отрицательного, а помещенный в более концентрированный – положительного электрода. Такие гальванические элементы получили название концентрационных.
Определите ЭДС концентрационного медного элемента с активностями ионов меди, равными 10-1 моль/л у одного электрода и 10-3 моль/л у другого при 298 К.
Решение. Рассчитаем равновесные потенциалы медных электродов по уравнению Нернста. Для первого электрода:
 ,
,
для второго электрода
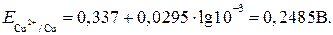
Из сравнения величин потенциалов видно, что первый электрод в данном элементе является катодом, второй электрод – анодом и ЭДС равна:
Еэ = Ек – Еа = 0,3075 – 0,2485 = 0,059 В.
Дата добавления: 2020-03-21; просмотров: 674;











