Химический потенциал компонента идеальных растворов.
Если общее давление газовой смеси невелико, то каждый газ будет оказывать свое собственное давление, причем такое, как если бы он один занимал весь объем. Это давление называется парциальным. Полное наблюдаемое давление р равно сумме парциальных давлений каждого газа (закон Дальтона):
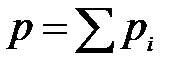 .
.
Химический потенциал компонента смеси идеальных газов равен:
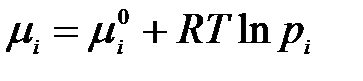 ,
,
где рi – парциальное давление газа.
Выражая парциальное давление газа рi через общее давление и мольную долю газа xi, получают выражение для зависимости химического потенциала i-го компонента от мольной доли:
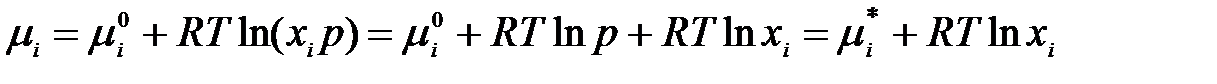 ,
,
где 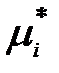 – химический потенциал идеального газа при xi = 1 (т.е. в индивидуальном состоянии) при давлении р и температуре Т;
– химический потенциал идеального газа при xi = 1 (т.е. в индивидуальном состоянии) при давлении р и температуре Т; 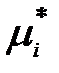 зависит и от температуры, и от давления.
зависит и от температуры, и от давления.
Для идеальных жидких растворов применимо уравнение
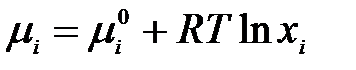 ,
,
где 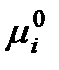 – стандартный химический потенциал индивидуального компонента в жидком состоянии (
– стандартный химический потенциал индивидуального компонента в жидком состоянии ( 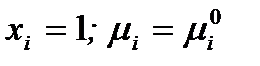 ) зависит от температуры и давления; xi – мольная доля компонента.
) зависит от температуры и давления; xi – мольная доля компонента.
Химический потенциал компонента реальных растворов.
Для реальных растворов все рассмотренные зависимости неприменимы. Химический потенциал компонента реального газового раствора рассчитывается по методу Льюиса. При этом для сохранения формы термодинамических уравнений вместо парциального давления в них вводят фиктивную величину fi, которая называется парциальной фугитивностью, или летучестью. Тогда
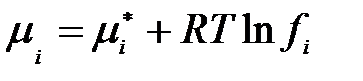 ,
,
где 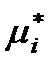 – химический потенциал компонента реальной газовой смеси в стандартном состоянии.
– химический потенциал компонента реальной газовой смеси в стандартном состоянии.
Отношение летучести к парциальному давлению реального газового раствора называется коэффициентом летучести:
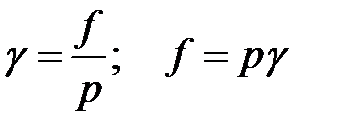 ;
;
Аналогично, для жидких реальных растворов действительную концентрацию заменяют соответствующей фиктивной величиной – активностью аi:
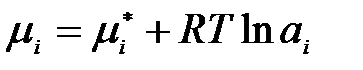 ,
,
где 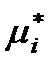 – химический потенциал компонента реального жидкого раствора в стандартном состоянии.
– химический потенциал компонента реального жидкого раствора в стандартном состоянии.
Активность связана с концентрацией через коэффициент активности:
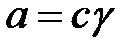 ,
,
где γi – коэффициент активности.
В зависимости от способа выражения концентрации раствора различают рациональный, молярный и моляльный коэффициенты активности:
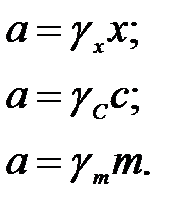
Коэффициент активности зависит от концентрации раствора. В бесконечно разбавленных растворах γ → 1, аi и fi → ci и pi соответственно.
Перепишем уравнение для химического потенциала в виде
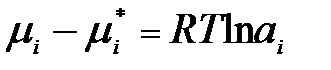 ,
,
следовательно, термодинамическая активность – это работа переноса 1 моль i-го компонента из стандартного раствора в данный реальный раствор.
Существует два основных способа выбора стандартного состояния – симметричный и несимметричный.
Симметричный способ. Выбирается одинаковое стандартное состояние для растворителя и растворенного вещества – состояние чистого компонента при температуре раствора. Тогда в стандартном состоянии xi = 1, ai = 1 и γi = 1. Данный способ чаще применяется для растворов неэлектролитов.
Несимметричный способ. Выбирается различное стандартное состояние для растворителя и растворенного вещества. Для растворителя – как и в симметричном способе: xi→1, ai→1 и γi→1. Для растворенного веществаза стандартное состояние выбирается состояние вещества в бесконечно разбавленном растворе: xi→0, ai→ xi и γi→1.Способ наиболее часто используется в термодинамике растворов электролитов.
Дата добавления: 2016-06-22; просмотров: 3818;











