Первые модели строения атома
В 1897 г. Дж. Томсон (Англия) открыл электрон, а в 1909 г. Р. Малликен определил его заряд, который равен 1,6 · 10-19 Кл. Масса электрона составляет 9,11 ∙ 10-28 г. В 1904 г. Дж. Томсон предложил модель строения атома, согласно которой атом можно представить в виде положительной сферы с вкрапленными электронами.
В 1910 г. в лаборатории Э. Резерфорда (Англия) в опытах по бомбардировке металлической фольги α-частицами было установлено, что некоторые α-частицы рассеиваются фольгой. Отсюда Резерфорд заключил, что в центре атома существует положительно заряженное ядро малого размера, окруженное электронами. Радиусы ядер лежат в пределах 10-14 – 10-15 м, т.е. в 104 – 105 раз меньше размера атома. Резерфорд предсказал существование протона и его массу, которая в 1800 раз превышает массу электрона.
В 1910 г. Резерфорд предложил ядерную планетарную модель атома, состоящего из тяжелого ядра, вокруг которого двигаются по орбитам электроны, подобно планетам солнечной системы. Однако, как показывает теория электромагнитного поля, электроны в этом случае должны двигаться по спирали, непрерывно излучая энергию, и падать на ядро.
Атомные спектры. При нагреве вещество испускает лучи (излучение). Если излучение имеет одну длину волны, то оно называется монохроматическим. В большинстве же случаев излучение характеризуется несколькими длинами волн. При разложении излучения на монохроматические компоненты получают спектр излучения, где отдельные его составляющие выражаются спектральными линиями. На рис 1.1. приведен атомный спектр водорода. Длины волн, соответствующие атомному спектру водорода, определяются уравнением Бальмера
 . (1.1)
. (1.1)
где λ – длина волны; R – постоянная Ридберга (109678 см-1); n и m – целые числа (n = 1 для серии Лаймана, n = 2 – для серии Бальмера, n = 3 – для серии Пашена; m = 2, 3, 4 для серии Лаймана, m = 3, 4, 5 для серии Бальмера, m = 4, 5, 6 – для серии Пашена).
Кванты и модель Бора.В 1900 г. М. Планк (Германия) высказал предположение, что вещества поглощают и испускают энергию дискретными порциями, названными им квантами. Энергия кванта Е пропорциональна частоте излучения (колебания) ν:
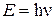 , (1.2)
, (1.2)
где – h – постоянная Планка (6,626∙10-34 Дж·с); ν = с/λ, с – скорость света; λ – длина волны.
В 1913 г. датский ученый Н. Бор, испльзуя модель Резерфорда и теорию Планка, предложил модель строения атома водорода, согласно которой электроны двигаются вокруг ядра не по любым, а лишь по разрешенным орбитам, на которых электрон обладает определенными энергиями.При переходе электрона с одной ориты на другую атом поглощает или испускает энергию в виде квантов. Каждая орбита имеет номер n (1, 2, 3, 4,…), который назвали главным квантовым числом. Бор вычислил радиусы орбит. Радиус первой орбиты был 5,29∙10-13 м, радиус других орбит был равен:
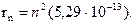 (1.3)
(1.3)
Энергия электрона (эВ) зависила от значения главного квантового
числа n:
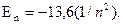 (1.4)
(1.4)
Отрицательный знак энергии означает устойчивость системы, которая тем более устойчива, чем ниже (чем более отрицательна) ее энергия. Атом водорода обладает минимальной энергией, когда электрон находится на первой орбите (n=1). Такое состояние называется основным. При переходе электрона на более высокие орбиты атом становится возбужденным. Такое состояние атома неустойчиво.
 Рис. 1.1. Схема энергетических уровней и квантовые переходы атома водорода
Рис. 1.1. Схема энергетических уровней и квантовые переходы атома водорода
| При переходе с верхней орбиты на нижнюю атом излучает квант света, что экспериментально обнаруживается в виде серий атомного спектра (рис.1.1.). Значения n и m в уравнении (1.1) соответствуют значениям главных квантовых чисел, с которых электрон переходит (m) и на которые электрон переходит (n). Теория Бора позволила рассчитать энергию электронов, значения квантов энергии, испускаемых при переходе электрона с одного уровня на другой. Теория Бора получила экспериментальное подтверждение. Однако Она не смогла объяснить поведение электрона в магнитном поле и все атомные спектральные линии. Теория Бора оказалась непригодной для многоэлектронных атомов. Возникла необходимость в новой модели атома, основанной на открытиях в микромире. |
Дата добавления: 2020-03-21; просмотров: 515;











