Строение многоэлектронных атомов
Электронная конфигурация элемента. Запись распределения электронов в атоме по оболочкам, подоболочкам и орбиталям получила название электронной кофигурации элемента. Обычно электронная конфигурация приводится для основного состояния атома
При записи электронной конфигурации указывают цифрами главное квантовое число (n), буквами – подоболочки (s,p,d или f), а степень буквенных обозначений подуровней обозначает число электронов в данной подоболочке.
Например, электронная конфигурация водорода – 1s1, лития – 1s22s1, бора – 1s22s22p1, магния – 1s22s22p63s2, титана – 1s22s22p63s23p63d24s2.
При составлении электронных конфигураций многоэлектронных атомов учитывают: принцип минимальной энергии, принцип Паули, правила Гунда и Клечковского.
Принцип минимальной энергии. Согласно этому принципу электроны в основном состоянии заполняют орбитали в порядке повышения уровня энергии орбиталей. Первыми заполняются орбитали с минимальными уровнями энергии.
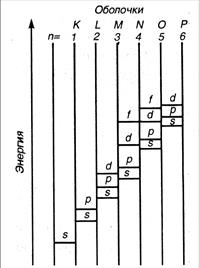 Рис. 1.3. Примерная схема относительного расположения энергетических подуровней в многоэлектронных атомах
Рис. 1.3. Примерная схема относительного расположения энергетических подуровней в многоэлектронных атомах
| В многоэлектронных атомах электроны испытывают не только притяжение ядер, но и отталкивание электронов, находящихся ближе к ядру и экранирующих ядро от более далеко расположенных электронов. Поэтому последовательность возрастания энергий орбиталей усложняется.
Правило В. Клечковского. Увеличение энергии и соответственно заполнение орбиталей происходит в порядке возрастания суммы квантовых чисел n + l, а при равной сумме – в порядке увеличения числа n. Соответственно этому правилу подоболочки выстраиваются в следующий ряд (см. рис. 1.3):
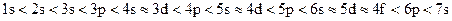 Исключение составляют d- и f-элементы с полностью и наполовину заполненными подоболочками, у которых наблюдается так называемый провал электронов, например Cu, Ag, Cr, Mo, Pd, Pt.
Исключение составляют d- и f-элементы с полностью и наполовину заполненными подоболочками, у которых наблюдается так называемый провал электронов, например Cu, Ag, Cr, Mo, Pd, Pt.
|
Принцип запрета Паули. В 1925 г. П. Паули постулировал принцип запрета, согласно которому в атоме не может быть двух электронов, обладающих одинаковым набором квантовых чисел n, l, ml и ms. Отсюда следует, что на каждой атомной орбитали может быть не более двух электронов, причем они должны иметь противоположные (антипараллельные) спины, т.е. допускается заполнение ↑↓ и не допускается заполнение ↓↓ и ↑↑.
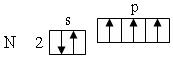
Правило Гунда. В соответствии с этим правилом заполнение орбиталей одной подоболочки в основном состоянии атома начинается одиночными электронами с одинаковыми спинами. После того как одиночные электроны займут все орбитали в данной подоболочке, заполняются орбитали вторыми электронами с противоположными спинами. Например, у атома азота орбитали в основном состоянии заполняют р-подоболочку 2р3 по одному электрону
Возбужденное состояние атома. Электронная пара, образующая связь, может образоваться за счет неспаренных электронов, имеющихся в невозбужденных атомах.
Однако число ковалентных связей может быть больше числа неспаренных электронов. Например, в невозбужденном состоянии (которое называется также основным состоянием) атом углерода имеет два неспаренных электрона, однако для него характерны соединения, в которых он образует четыре ковалентные связи. Это оказывается возможным в результате возбуждения атома. При этом один из s-электронов переходит на p-подуровень:
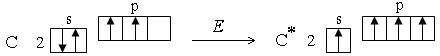
Увеличение числа создаваемых ковалентных связей сопровождается выделением большего количества энергии, чем затрачивается на возбуждение атома. Поскольку валентность атома зависит от числа неспаренных электронов, возбуждение приводит к повышению валентности. У атомов азота, кислорода, фтора количество неспаренных электронов не увеличивается, т.к. в пределах второго уровня нет свободных орбиталей, а перемещение электронов на третий квантовый уровень требует значительно большей энергии, чем та, которая выделилась бы при образовании дополнительных связей. Таким образом, при возбуждении атома переходы электронов на свободные орбитали возможны только в пределах одного энергетического уровня.
Элементы 3-го периода – фосфор, сера, хлор – могут проявлять валентность, равную номеру группы. Это достигается возбуждением атомов с переходом 3s- и 3p-электронов на вакантные орбитали 3d-подуровня:
P* 1s22s22p63s13p33d1 (валентность 5)
S* 1s22s22p63s13p33d2 (валентность 6)
Cl* 1s22s22p63s13p33d3 (валентность 7)
В приведенных выше электронных формулах возбужденных атомов подчеркнуты подуровни, содержащие только неспаренные электроны. На примере атома хлора легко показать, что валентность может быть переменной:
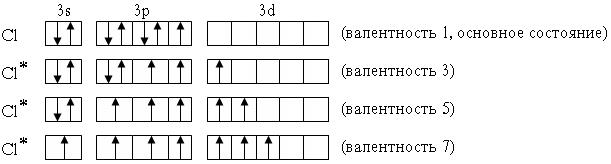
В отличие от хлора, валентность атома F постоянна и равна 1, т.к. на валентном (втором) энергетическом уровне отсутствуют орбитали d-подуровня и другие вакантные орбитали.
Дата добавления: 2020-03-21; просмотров: 545;











