Первый закон термодинамики
Первый закон термодинамики представляет собой всемирный закон сохранения энергии. Энергия не исчезает и не возникает вновь, она только переходит из одних видов в другие в различных физических и химических процессах.
Энергия изолированной системы (системы, которая не обменивается с ОС ни веществом, ни энергией) постоянна. Для неизолированных систем изменение внутренней энергии ТДС равна алгебраической сумме внешних воздействий
Уравнение первого закона термодинамики для процессов, протекающих в ТДС со многими степенями свободы, может быть записано для произвольного процесса так:
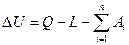
В дифференциальной форме для элементарного (бесконечно малого) процесса:
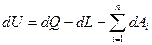
Где dU – бесконечно малое изменение внутренней энергии;
dQ, dL, dAi – бесконечно малые количества теплоты, работы объемного расширения и другие виды работ соответственно.
Для ТДС с равномерным распределением параметров все уравнения запишутся для удельных величин:
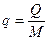 ,
, 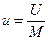 ,
, 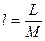 ,
, 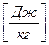
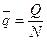 ,
, 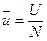 ,
, 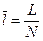
Для простой термодеформационной системы:
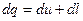
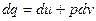 ;
;
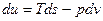 ;
;
Эти уравнения называют основным термодинамическим тождествам или первой формой записи первого закона термодинамики с использованием параметра внутренняя энергия.
Рассмотрим уравнение
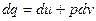 ,
,
если к нему добавить и вычесть выражение 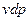 , то получим
, то получим
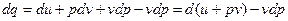
т.к. 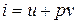 , то
, то
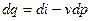
Это 2- я форма записи 1-го закона термодинамики с использованием параметра «энтальпия».
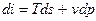
Поскольку 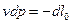 , получаем
, получаем
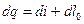
Это дополнительное уравнение 2-й формы записи 1-го закона термодинамики с использованием параметров «энтальпия» и «располагаемая работа».
Рассмотрим форму записи:
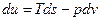 ,
,
Если прибавить и отнять sdT, получаем:
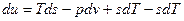
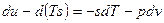
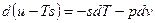
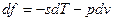
– это 3я форма записи первого закона термодинамики с использованием параметра свободная энергия.
Рассмотрим форму записи:
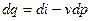
Если прибавить и отнять sdT, получаем:
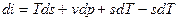
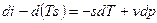
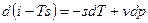
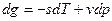
Это 4ая форма записи первого закона термодинамики с использованием параметра свободная энтальпия.
Все реальные процессы, протекающие в двигателях, являются неравновесными, однако, в технической термодинамике их заменяют соответствующими равновесными процессами. Зная уравнения первого закона и уравнение состояния газов легко рассмотреть основные процессы – изобарный, изохорный, изотермический, адиабатный и обобщающий – политропный.
Из первого закона термодинамики есть важные для термодинамического анализа следствия.
Рассмотрим первый закон термодинамики для случая изобарного процесса (процесса, в котором давление постоянно): (р=const, dр=0). В этом процессе теплоемкость равна изобарной теплоемкости с=ср В результате для изобарного процесса получаем:
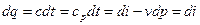
То есть, как для изобарного, так и для любого политропного процесса в простой термодинамической системе справедливо утверждение:
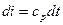 (*)
(*)
Рассмотрим первый закон термодинамики для случая изохорного процесса (процесса, в котором объем постоянен): (v=const, dv=0). В этом процессе теплоемкость равна изохорной теплоемкости с=сv В результате для изохорного процесса уравнение получаем:
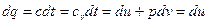
То есть, как для изохорного, так и для любого политропного процесса в простой термодинамической системе справедливо утверждение:
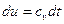 (**)
(**)
Если разделить уравнения [* и **] друг на друга, получаем:
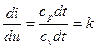 , или
, или 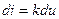
Дата добавления: 2020-03-21; просмотров: 870;











