Термодинамические процессы идеального газа
Идеальный газ – это газ, строго подчиняющийся закону идеального газа
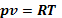 (3.1.)
(3.1.)
и его частицы представляют собой материальный точки, между которыми отсутствует силовое взаимодействие.
Термодинамическим процессом называют процесс изменения состояния системы в результате ее взаимодействия с ОС.
Политропный процесс – процесс, при котором доля тепла, идущая на изменение внутренней энергии рабочего тела, остается постоянной величиной. Ряд термодинамических процессов идеального газа (изобарный, изохорный, изотермический и адиабатный) можно считать частными случаями политропного процесса.
Равновесным процессом называют процесс, в ходе которого система проходит через бесконечное множество бесконечно близких равновесных состояний.
Количество теплоты, участвующее в политропном процессе, может быть выражено произведением теплоемкости процесса с на разность температур в начале и конце процесса:
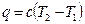 и
и 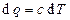 (3.2)
(3.2)
Уравнение политропного процесса выводится на основании совместного решения первой и второй форм записи первого закона термодинамики:
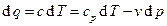 , (3.3)
, (3.3)
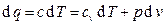 (3.4)
(3.4)
из которых после несложных преобразований получаем:
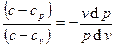 (3.5)
(3.5)
Обозначив показатель политропы как n
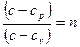 (3.6)
(3.6)
получаем уравнение политропного процесса в дифференциальной форме:
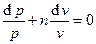 (3.7)
(3.7)
откуда уравнение политропного процесса в интегральной форме имеет вид:
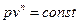 (3.8)
(3.8)
Это уравнение используется для построения рабочей диаграммы (графического изображения процесса в p-v координатах) – см. рисунок 3.1.
Нетрудно заметить, что вид процесса определяется показателем процесса n.
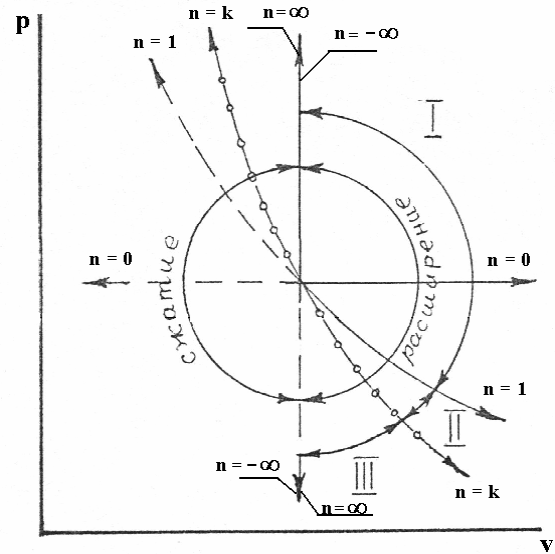
Рисунок 3.1 – различные частные случаи политропного процесса в p-v координатах: n=0 – изохорный; n=±∞ - изобарный; n=1 – изотермический n= k – адиабатный.
Решая совместно уравнение (3.8) и уравнение состояния (3.1), можно получить соотношения параметров в начале и конце процесса (см. табл. 3.1).
Изменение внутренней энергии газа определяется по формуле:
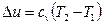 (3.9)
(3.9)
Работа расширения l может быть найдена из первой формы записи уравнения первого закона термодинамики (2):
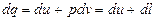 , (3.10)
, (3.10)
По определениям данных функций, dq=cdT и du=cvdT, откуда
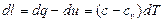 (3.11)
(3.11)
После интегрирования и преобразований получаем:
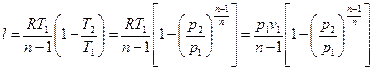 ,(3.12)
,(3.12)
Располагаемая работа l0 может быть найдена из второй формы записи первого закона термодинамики (3):
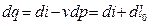 (3.13)
(3.13)
По определениям данных функций, dq=cdT и di=cpdT, откуда
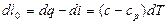 (3.14)
(3.14)
После интегрирования и преобразований получаем:
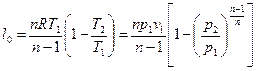 , (3.15)
, (3.15)
таким образом
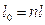
Изменение энтропии газа в политропном процессе определяется по формуле
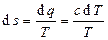 (3.16)
(3.16)
или для конечного изменения состояния (т.к. k=сp/сv)
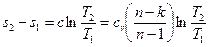 (3.17)
(3.17)
С помощью этого уравнения можно построить график процесса на тепловой диаграмме (в T-s координатах) – см. рисунок 3.2.
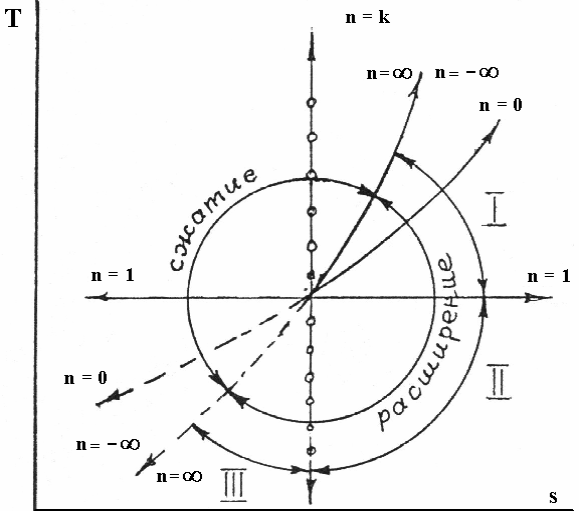
Рисунок 3.2 – различные частные случаи политропного процесса в T-s координатах: n=0 – изохорный; n=±∞ - изобарный; n=1 – изотермический n= k – адиабатный.
Особенности превращения энергии зависят от показателя политропы. Все процессы могут быть разделены на 3 характерные группы. Рассмотрим группы процессов в области расширения ( 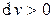 ,
, 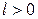 )
)
1 группа, 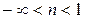
В процессах этой группы 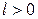 ,
, 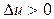 ,
, 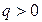 ,
, 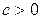
Таким образом в процессах этой группы при расширении теплота подводится и частично расходуется на совершение работы и увеличение энергии рабочего тела. С увеличением 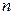 возрастает доля тепла, идущая на совершение работы
возрастает доля тепла, идущая на совершение работы
2 группа, 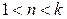
Для этих процессов 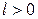 ,
, 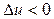 ,
, 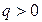 ,
, 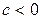
В процессах этой группы при расширении газа работа совершается как за счет подвода тепла так и за счет уменьшения внутренней энергии рабочего тела. С увеличением показателя политропы (от 1 до k) возрастает доля работы, совершаемая за счет внутренней энергии и уменьшается доля работы, совершаемая за счет подвода теплоты.
3 группа, 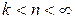
Для процессов этой группы 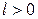 ,
, 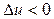 ,
, 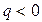 ,
, 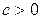
При расширении рабочего тела уменьшается его внутренняя энергия, часть ее расходуется на совершение работы, а часть отводится в виде теплоты; с увеличением показателя политропы увеличивается отвод теплоты за счет уменьшения количества совершенной работы.
При анализе тепловых машин часто вместо политропного процесса рассматривают его частные случаи – изобарный, изохорный, изотермический или адиабатный.
Изохорный процесс
Изохорный процесс– процесс, при котором объем ТДС не изменяется.
1) Уравнение процесса при независимых переменных 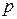 ,
, 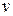 :
:
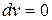 ,
, 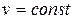 .
.
2) График процесса в системе координат 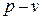 – прямая параллельная оси давлений. Кривая процесса называется изохорой (см. рисунок 3.1.)
– прямая параллельная оси давлений. Кривая процесса называется изохорой (см. рисунок 3.1.)
3) Соотношение между параметрами в процессе.
Из уравнения состояния идеального газа
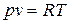 при
при 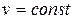
получаем
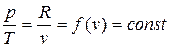 .
.
При постоянном объеме давление газа изменяется прямо пропорционально абсолютным температурам:
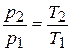 .
.
4) Теплоемкость рабочего тела в процессе
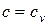 .
.
5) Изменение внутренней энергии и энтальпии в процессе
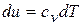 ;
;
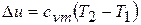 ;
;
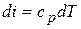 ;
;
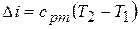 .
.
6) Работа расширения 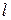 и располагаемая работа
и располагаемая работа 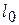 (полезная внешняя работа, которая может быть передана внешнему объекту работы) процесса:
(полезная внешняя работа, которая может быть передана внешнему объекту работы) процесса:
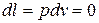 ,
, 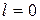 ;
;
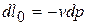 ,
, 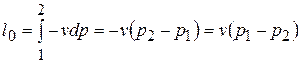 ,
,
на графике 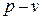 располагаемая работа численно равна площади между линией процесса и осью давлений. Из полученного выражения видно, что полезная внешняя работа в изохорном процессе равна работе проталкивания
располагаемая работа численно равна площади между линией процесса и осью давлений. Из полученного выражения видно, что полезная внешняя работа в изохорном процессе равна работе проталкивания 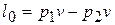 . Например, проталкивание несжимаемой жидкости по каналу от одного сечения к другому.
. Например, проталкивание несжимаемой жидкости по каналу от одного сечения к другому.
7) Количество тепла, участвующего в процессе.
Основное уравнение первого закона термодинамики при 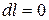 принимает вид
принимает вид
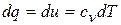 ,
,
количество теплоты участвующее в процессе
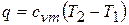 .
.
8) Особенности превращения энергии в процессе
Вся энергия, подведенная к ТДС в форме теплоты, идет на увеличение внутренней энергии и температуры, работа расширения процесса равна нулю.
9) Изменение энтропии в процессе
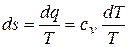 ,
,
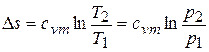 .
.
10) График процесса в системе координат 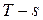 (тепловая диаграмма)– логарифмическая кривая (см. рисунок 3.2.)
(тепловая диаграмма)– логарифмическая кривая (см. рисунок 3.2.)
Подкасательная к кривой в любой ее точке дает значение истинной теплоемкости 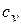 .
.
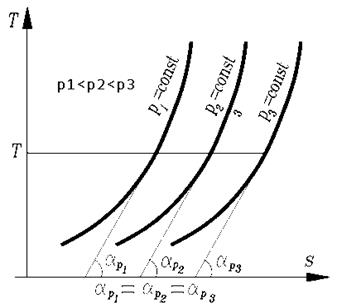
Изохоры, построенные для различных объемов, смещены одна относительно другой, и чем больше объем газа, тем дальше находится изохора от оси ординат.
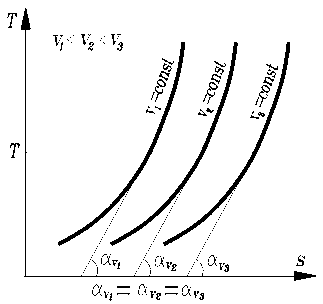
Изобарный процесс
Изобарный процесс- процесс в котором давление в ТДС остается постоянным:
1) Уравнение процесса в дифференциальной форме:
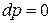 ,
, 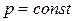 .
.
2) График процесса в системе координат 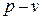 – прямая параллельная оси объемов. Кривая процесса называется изобарой. (см. рисунок 3.1.)
– прямая параллельная оси объемов. Кривая процесса называется изобарой. (см. рисунок 3.1.)
3) Соотношение между параметрами в процессе.
Из уравнения состояния идеального газа
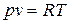 при
при 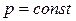
получаем
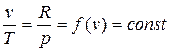 .
.
Это соотношение называется законом Гей-Люссака.
При постоянном давлении объем газа изменяется прямо пропорционально абсолютным температурам:
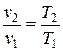 .
.
4) Теплоемкость рабочего тела в процессе
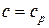 .
.
5) Изменение внутренней энергии и энтальпии в процессе
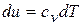 ;
;
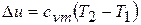 ;
;
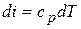 ;
;
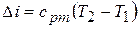 .
.
6) Работа расширения 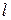 и располагаемая работа
и располагаемая работа 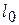 (полезная внешняя работа, которая может быть передана внешнему объекту работы) процесса:
(полезная внешняя работа, которая может быть передана внешнему объекту работы) процесса:
а) 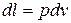 ,
, 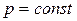 ;
;
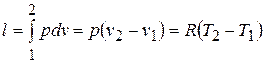 ,
,
на графике 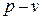 работа объемного расширения численно равна площади между линией процесса и осью удельных объемов.
работа объемного расширения численно равна площади между линией процесса и осью удельных объемов.
б) 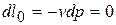 ,
, 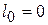 ,
,
т.е. располагаемая работа в изобарном процессе не совершается.
7) Количество тепла, участвующего в процессе.
Основное уравнение первого закона термодинамики при 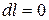 принимает вид
принимает вид
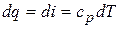 ,
,
количество теплоты участвующее в процессе
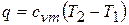 .
.
8) Особенности превращения энергии в процессе
Теплота, подведенная к рабочему телу расходуется на изменение его энтальпии.
9) Изменение энтропии в процессе
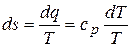 ,
,
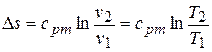 .
.
10) График процесса в системе координат 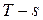 (тепловая диаграмма)– логарифмическая кривая. (см. рисунок 3.2.)
(тепловая диаграмма)– логарифмическая кривая. (см. рисунок 3.2.)
Подкасательная к кривой в любой ее точке дает значение истинной теплоемкости 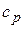 .
.
Изобары, построенные для различных давлений, смещены одна относительно другой и чем больше давление газа, тем ближе находится изобара к оси ординат.
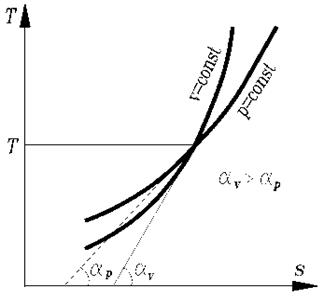
Из сопоставления уравнений изменения энтропии в процессе следует, что в случае осуществления изохорного и изобарного процессов в одном интервале температур возрастание энтропии будет больше в изобарном процессе, т.к. 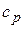 всегда больше
всегда больше 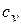 .
.
Изобары являются более пологими кривыми, чем изохоры.
Дата добавления: 2020-03-21; просмотров: 969;











