Уравнение состояния реального газа
Одна из первых попыток создать уравнение состояния реального газа принадлежит голландскому физику Я. Ван дер Ваальсу (1873г.). На основе, главным образом, умозрительных заключений и идеи непрерывности газообразного и жидкого состояний вещества он предложил уравнение, охватывающее оба эти состояния
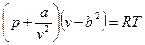 .
.
Это уравнение отличается от уравнения состояния идеального газа тем, что в него входят два дополнительных члена:
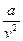 – дополнительное внутреннее давление, вызываемое взаимным приближением молекул;
– дополнительное внутреннее давление, вызываемое взаимным приближением молекул;
b – суммарный объем молекул.
Входящие в уравнение Ван дер Ваальса константы а и b вместе с газовой постоянной R характеризуют индивидуальные свойства вещества.
К сожалению, равнение Ван дер Ваальса учитывает лишь объем молекул и их взаимодействие, что отвечает случаю парных взаимодействий между молекулами, т.е. случаю, результатом которого является лишь обмен энергией между молекулами при соударении. При возрастании плотности газа возрастает число случаев соударений, в которых участвует 3 и более молекул. При этом две и более молекул могут получить равную по величине и направлению скорость, т.е. двигаться как единое целое (ассоциация молекул), а избыток энергии уносится другими молекулами, участвующими в соударении. Таким образом, как бы сокращается число автономных частиц газа, что, естественно, отражается на его поведении.
В результате уравнение Ван дер Ваальса применимо лишь к области сравнительно малых скоростей. Ван дер Ваальсовский газ можно рассматривать как второе после идеального газа приближение к реальному газу.
Уравнение Ван дер Ваальса в принципе неприменимо к области, где вещество обладает резко выраженными свойствами реального газа (вблизи линии насыщения, околокритическая область), и тем более к области жидкости.
В связи с этим предпринималось большое число попыток вывода теоретически обоснованного уравнения состояния справедливого в достаточно широкой области состояний реального газа. Большой шаг вперед в этом направлении был сделан в 1937-1946 гг.независимо друг от друга американским физиком Дж. Майером и советским математиком Н.Н. Боголюбовым. С помощью методов статистической физики они показали, что уравнение состояния реального газа в наиболее общем виде выглядит следующим образом
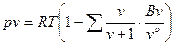 .
.
Это уравнение носит название уравнения Майера-Боголюбова.
Здесь В и 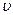 – вириальные коэффициенты, зависящие от потенциальной энергии взаимодействия молекул и температуры газа.
– вириальные коэффициенты, зависящие от потенциальной энергии взаимодействия молекул и температуры газа.
Чисто теоретическими методами они не могут быть вычислены и требуют ряда экспериментальных сведений.
Эта задача обычно оказывается настолько сложной, что более целесообразным путем является получение уравнения состояния в виде интерполяционной формулы, описывающей экспериментальные данные. В инженерной практике определение параметров состояния реального газа, анализ процессов изменения его состояния во многих случаях проводится на основе использования соответствующих таблиц и диаграмм. Их применение мы рассмотрим на примере такого широко используемого реального газа, каким является водяной пар.
Дата добавления: 2018-11-26; просмотров: 966;











