Устройство pv – диаграммы реального газа
Впервые подробное экспериментальное исследование зависимости p от v в разных изотермических процессах сжатия реального газа провел на углекислоте в 1857 – 1969 г.г. английский физик Эндрюс. Результаты его экспериментов показаны на рис. 1.
Как видно, при температурах, меньших 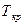 , изотермическое сжатие углекислоты (СО2) вначале сопровождается ростом давления. В точке а начинается процесс конденсации. Состояние, отвечающее этой точке, называют сухим насыщенным паром. При продолжении изотермического сжатия давление остается постоянным, а уменьшение объема сопровождается тем, что все большее количество пара превращается в жидкость.
, изотермическое сжатие углекислоты (СО2) вначале сопровождается ростом давления. В точке а начинается процесс конденсации. Состояние, отвечающее этой точке, называют сухим насыщенным паром. При продолжении изотермического сжатия давление остается постоянным, а уменьшение объема сопровождается тем, что все большее количество пара превращается в жидкость.
Наконец, в точке b конденсация завершается, и рабочее тело представляет собой кипящую жидкость. На участке ab одновременно существует и жидкая и газообразная фазы. Состояния, характеризуемые точками на ab, называют влажным насыщенным паром.
Соотношение между паровой и жидкой фазой характеризуют степенью сухости пара - это массовая доля сухого насыщенного пара во влажном. Степень сухости пара определяется выражением
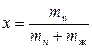 ,
,
где mn и mж – соответственно масса пара и жидкости во влажном насыщенном паре.
Удельный объем сухого насыщенного пара обозначают 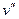 (точка а), а кипящей жидкости –
(точка а), а кипящей жидкости – 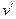 (точка b).
(точка b).

Рис. 1. PV – диаграмма реального газа
При продолжении изотермического сжатия в области v < v' отмечается резкое возрастание давления, так как жидкость обладает малой сжимаемостью.
С ростом температуры разность (v" - v'), быстро убывает за счет интенсивного уменьшения v" и некоторого роста v', т.е. с ростом температуры уменьшается разница между плотностями жидкой и газовой фаз.
Уменьшение (v" - v') продолжается вплоть до температуры Ткр, когда эта разность обращается в нуль (точка К), т.е. в этой точке исчезает различие между плотностями жидкости и пара. Точка К, отвечающая этому состоянию, называется критической точкой. Соответственно давление, температура и удельный объем называются критическими (ркр, Ткр, vкр). Естественно, что все попытки обеспечить путем изотермического сжатия сжижение газа при Т > Ткр, обречены на неудачу.
Критической температуре можно дать молекулярно-кинетическое толкование. Объединение свободнодвижущихся молекул в каплю, жидкости при сжижении газа происходит исключительно под действием сил взаимного притяжения. Этому препятствует кинетическая энергия движения молекул, равная с среднем kT (k – постоянная Больцмана). Очевидно, объединение молекул в каплю может произойти лишь при том условии, что кинетическая энергия движения молекул, пропорциональная Т, меньше или равна потенциальной энергии из взаимного притяжения (uo). Если кинетическая энергия больше потенциальной энергии взаимного притяжения, то конденсация жидкости при изотермическом сжатии не сможет произойти. Сопоставление этих положений с результатом анализа диаграммы Эндрюса позволяет сделать вывод о том, что Ткр – температура, соответствующая равенству указанных энергий
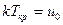 .
.
Если 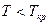 , то
, то 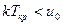 и конденсация при изотермическом сжатии возможна.
и конденсация при изотермическом сжатии возможна.
Если 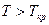 , то
, то 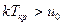 и конденсация при изотермическом сжатии не возможна.
и конденсация при изотермическом сжатии не возможна.
Дата добавления: 2018-11-26; просмотров: 945;











