Произведение растворимости
1. Для выражения растворимости практически нерастворимых веществ используется условная величина – произведение растворимости ПР.
При контакте воды с поверхностью практически нерастворимого вещества, например СаCO3 начинается выход в раствор незначительного количества ионов Ca2+ и CO 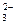 . Так как скорость растворения υ1 зависит от количества ионов на поверхности, то можно допустить, что с течением времени она не меняется, то есть:
. Так как скорость растворения υ1 зависит от количества ионов на поверхности, то можно допустить, что с течением времени она не меняется, то есть:
υ1 = κ1
При повышении концентрации ионов в растворе увеличивается υ2 - скорость перехода ионов из раствора на поверхность твердой фазы. υ2 зависит от активности ионов, а для сильно разбавленных растворов от концентрации ионов в растворе и выражается уравнением:
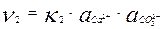
При определенной концентрации ионов в растворе скорости растворения и осаждения становятся равны, то есть υ1 = υ2. Следовательно
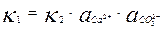 , отсюда
, отсюда 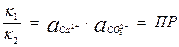
Отношение 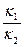 - величина постоянная, характеризует растворимость труднорастворимого электролита и называется произведением растворимости. В насыщенном растворе CaCO3 существует равновесие
- величина постоянная, характеризует растворимость труднорастворимого электролита и называется произведением растворимости. В насыщенном растворе CaCO3 существует равновесие
СаCO3 ↔ Ca2+ + CO 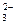
твердая фаза раствор
ПР 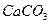 = a
= a 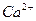 ∙ a
∙ a 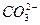 =4,8 ∙10-9 моль/л.
=4,8 ∙10-9 моль/л.
Если при диссоциации электролита, образуется несколько одинаковых ионов, то ПР равно произведению активностей ионов в степени, соответствующей количеству ионов.
Mg3 (PO4)2 ↔ 3Mg2+ + 2PO 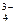
ПР 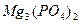 = a 3
= a 3 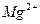 ∙ a 2
∙ a 2 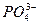 . Если произведение активностей ионов <ПР – раствор является ненасыщенным.
. Если произведение активностей ионов <ПР – раствор является ненасыщенным.
Если оно равно ПР, то раствор будет насыщенным .
Если произведение активностей ионов > ПР, то раствор является пересыщенным.
Представив вместо активностей ионов значения их концентраций, получим:
a 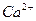 = γ
= γ 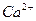 ∙ [Са2+]; a
∙ [Са2+]; a 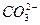 = γ
= γ 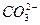 ∙[СО
∙[СО 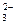 ], где
], где
γ – коэффициент активности, то есть отношение активности к истинной концентрации. Тогда
ПР 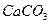 = γ
= γ 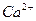 [Са2+]∙γ
[Са2+]∙γ 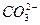 [СО
[СО 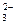 ]
]
Коэффициенты активности ионов с одинаковой величиной зарядов равны. Следовательно ПР 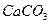 =γ2[Са2+]∙γ[СО
=γ2[Са2+]∙γ[СО 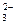 ], то есть [Са2+][СО
], то есть [Са2+][СО 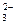 ]=ПР
]=ПР  /γ2.
/γ2.
Так как концентрации ионов [Са2+] = [СО 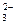 ], то концентрация каждого из них будет соответствовать молярной концентрации насыщенного раствора.
], то концентрация каждого из них будет соответствовать молярной концентрации насыщенного раствора.
[Са2+] = [СО 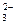 ]=
]= 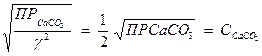 .
.
В сильноразбавленных растворах, когда γ = 1
С(моль/л) = 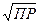 , где
, где
С – молярная концентрация насыщенного раствора бинарного электролита. При введении в насыщенный раствор труднорастворимого электролита другого электролита, не содержащего с ним одноименных ионов, наблюдается повышение растворимости. Это явление называется солевым эффектом.
ГИДРОЛИЗ СОЛЕЙ
Гидролизом называется взаимодействие вещества с водой, при котором составные части вещества соединяются с составными частями воды.
Гидролизу подвержены соединения разных классов, мы будем рассматривать гидролиз солей.
В реакции гидролиза вступают соли образованные: слабой кислотой и слабым основанием; слабой кислотой и сильным основанием; сильной кислотой и слабым основанием.
Дата добавления: 2020-02-05; просмотров: 784;











