Равновесие в гомогенных системах.
Химическая реакция, протекающая в пределах одной фазы, – гомогенная реакция. Все реакции делятся на обратимые и необратимые. Необратимые реакции протекают в одном направлении до конца. Обратимые реакции протекают при одних и тех же заданных условиях одновременно в двух противоположных направлениях.
А+В ↔ С+Д
Обратимая реакция протекает только до определенного момента, когда Vпр и Vобр становятся одинаковыми, то есть в системе наступает динамическое равновесие.
V1 = k1[A][B]
V2 = k2[C][Д]
V1 = V2 , следовательно k1[A][B] = k2[C][Д], следовательно:
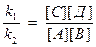 или
или 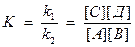
К – константа равновесия.
В общем виде:
аА + вВ ↔сС + dД
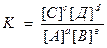
Ле Шателье (1887г): если изменить одно из условий, при котором установилось равновесие (t, p, C), то произойдет смещение равновесия в направлении процесса, препятствующего производимому изменению.
Увеличение температуры вызывает усиление эндотермической реакции.
Увеличение давления смещает равновесие в сторону образования меньшего числа молекул.
Увеличение концентрации веществ, стоящих в одной части равенства, вызывает образование веществ в другой части равенства.
Дата добавления: 2020-02-05; просмотров: 750;











