Диссоциация воды, активная реакция среды
Вода – очень слабый амфотерный электролит. Он диссоциирует на ионы по уравнению Н2О ↔ Н+ + ОН-. Равновесие это определяется законом действия масс:
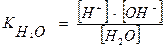 (I)
(I)
Это константа диссоциации воды. Она равна (при Т =25 0С) 1,89 · 10-16.
Так как степень диссоциации воды очень мала, то можно принять [Н2О] постоянной. Тогда равенство I можно записать в следующем виде:
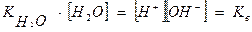 ,
,
где Кв – ионное произведение воды.
При постоянной температуре Кв является величиной постоянной, так как
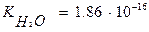 , а концентрация недиссоциированных молекул воды практически (т. к. степень диссоциации ничтожна) равна общему числу моль воды в литре.
, а концентрация недиссоциированных молекул воды практически (т. к. степень диссоциации ничтожна) равна общему числу моль воды в литре.
То есть 1000: 18 = 55,56, то
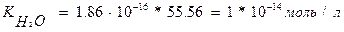 .
.
Если реакция среды нейтральна, то [H+] = 1·10-7 моль/л. Если в растворе имеется кислота или щелочь, то при этом резко меняется концентрация водородных или гидроксильных ионов, но ионное произведение воды остается величиной постоянной при Т0 – const.
Любое повышение концентрации ионов водорода вызывает соответствующее уменьшение концентрации гидроксильных ионов.
Например: определить [ОН-] в растворе, если концентрация [Н+] = 1·10-2 моль/л.
[Н+] [ОН-]=1·10-14
[ОН-]= (1·10-14) : (1·10-2) = 1·10-12 моль/л.
Пользуясь ионным произведением можно характеризовать реакцию среды с помощью концентрации ионов водорода. В кислой среде [Н+] будет выше, чем в щелочной, и тем выше, чем выше кислотность, а в щелочной тем меньше, чем выше щелочность.
Практически пользуются не самой величиной концентрации водородных ионов, а водородным показателем рН.
рН = - lg [Н+], который равен отрицательному десятичному логарифму концентрации ионов водорода, выраженный в моль/л.
Так если [Н+] = 1·10-5, то рН =5. Если реакция среды нейтральна, то рН =7, в щелочной среде рН > 7 и в кислой рН <7.
Дата добавления: 2020-02-05; просмотров: 857;











