Теория сильных электролитов
При растворении электролитов происходит диссоциация их молекул. Способность вещества к образованию ионов выражается степенью диссоциации (α).
α = (число молекул распавшихся на ионы)/ (общее число молекул вещества).
Электролиты делятся на:
- слабые электролиты,
- сильные электролиты.
Процесс диссоциации слабых электролитов обратимый
Н2СО3 ↔ Н+ + НСО 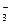
К1 = 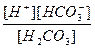 .
.
Сильные электролиты не подчиняются закону действия масс. Константа диссоциации сильных электролитов зависит от концентрации, при повышенной концентрации она уменьшается.
П. Дебай и Э Хюккель (1923г.) - теория сильных электролитов: растворы сильных электролитов состоят только из ионов.
Ионы в растворе распределяются также как в кристаллах, но на большем расстоянии друг от друга. Их взаимное влияние ослабляется присутствием молекул растворителя. В сильно разбавленных растворах взаимное влияние их ионов слабо и кажущаяся степень диссоциации приближается к 100%. Увеличение концентрации вызывает увеличение взаимного влияния и кажущаяся степень диссоциации уменьшается. При увеличении концентрации раствора подвижность ионов снижается, поэтому растворы сильных электролитов характеризуются величиной активной концентрацией (а), которая меньше истинной.
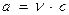
а - активная концентрация, моль/л;
с – истинная концентрация, моль/л;
ν – коэффициент активности.
Если в растворе находится смесь электролитов, то электростатическое действие ионов друг на друга характеризуется ионной силой раствора (I)
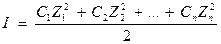 , где
, где
С1, С2, …, Сn - истинные концентрации отдельных ионов.
Z1, Z2, …, Zn - заряды ионов.
2.6 Коэффициент активности (ν)
Коэффициент активности (ν)не зависит от химической природы иона и одинаков для всех равнозарядных ионов при определенной ионной силе раствора. В водах с малым солесодержанием (до 200 мг/л) ν- не принимают во внимание. При большой концентрации электролита необходимо учитывать ν. Для растворов с ионной силой до 0,01 ν рассчитывается по формуле:
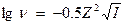 . При I - от 0,5 до 0,01, коэффициент активности рассчитывается по формуле:
. При I - от 0,5 до 0,01, коэффициент активности рассчитывается по формуле:
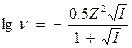
Эта формула применима для точного расчета коэффициента активности растворов с концентрацией до 50 ммоль/дм3.
Дата добавления: 2020-02-05; просмотров: 902;











