Частицы, участвующие в химической реакции
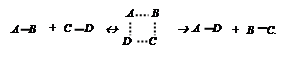 В ходе реакции происходит преобразование химических связей в реагентах. Оно представляет собой разрыв химических связей в молекулах исходных веществ и образование новых химических связей в продуктах реакции. Этот процесс может осуществляться двумя путями. Во-первых, в результате столкновения двух молекул образуется нестабильная промежуточная частица, в состав которой входят все атомы исходных веществ, объединенные общей системой химических связей, которая в дальнейшем может образовать либо продукты реакции, либо исходные вещества. В этом случае процесс протекает в одну стадию, химическая реакция является элементарной:
В ходе реакции происходит преобразование химических связей в реагентах. Оно представляет собой разрыв химических связей в молекулах исходных веществ и образование новых химических связей в продуктах реакции. Этот процесс может осуществляться двумя путями. Во-первых, в результате столкновения двух молекул образуется нестабильная промежуточная частица, в состав которой входят все атомы исходных веществ, объединенные общей системой химических связей, которая в дальнейшем может образовать либо продукты реакции, либо исходные вещества. В этом случае процесс протекает в одну стадию, химическая реакция является элементарной:
Во-вторых, химический процесс может реализоваться путем протекания как минимум двух последовательных элементарных реакций. Первая стадия такого процесса состоит в предварительном разрыве химических связей в молекулах исходных веществ с образованием отдельных фрагментов, которые могут быть заряжены, – ионы и не заряжены – свободные атомы и свободные радикалы. Последующее взаимодействие этих частиц приводит к образованию новых молекул. Например, превращение молекул АВ и СD в молекулы АD и ВС может быть описано следующими схемами:
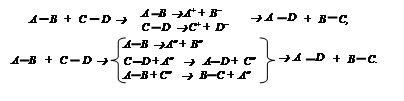 |
Распад молекулы на отдельные фрагменты называется диссоциацией. Разорвать химическую связь в молекулах вещества можно двумя путями. Во-первых, разорвав общую электронную пару. Такой разрыв называется гомолитическим. При этом образуются частицы, обладающие неспаренными электронами: свободные атомы или фрагменты молекул, состоящие из нескольких атомов – свободные радикалы. При записи эти частицы обозначаются точкой в виде верхнего индекса химической формулы.
Пример.
Н2 ® H· + H·,
HF ® H· + F·,
CH4 ® H· + CH3·.
Наличие у свободных атомов и радикалов неспаренных электронов обусловливает их повышенную реакционную способность по сравнению с молекулами.
Диссоциация молекул может также происходить без разрыва общей электронной пары, путем ее перехода к одному из фрагментов с образованием положительно и отрицательно заряженных ионов. Такой разрыв называется гетеролитическим. Электрический заряд ионов определяет их повышенную реакционную способность по сравнению с молекулами.
Пример.
Н2O ® H+ + OH-,
HF ® H+ + F-,
CsCl ® Cs+ + Cl-.
Как видно из табл. 2.1, в газовой фазе энергия гетеролитического разрыва связей, как правило, значительно превышает энергию гомолитического разрыва. Только для молекул, в которых связь сильно поляризована (ионный тип связи) энергии гомолитического и гетеролитического разрывов различаются не сильно. Как правило, образование свободных атомов и радикалов на первой стадии происходит при относительно высоких температурах (термическая диссоциация), при поглощении квантов света (фотохимические реакции) или частиц ионизирующего излучения (радиационно–химические реакции). Поэтому реакции в газовой фазе протекают преимущественно с участием радикалов.
Таблица 2.1
Дата добавления: 2020-02-05; просмотров: 931;











