Химический потенциал
Энергетические превращения, происходящие в системах при совершении процессов в различных условиях, описываются с использованием соответствующих термодинамических функций U, H, G, A. Необходимо отметить, что эти функции вводились для идеального процесса, в котором количество каждого вещества считалось неизменным и равным одному молю. Однако их величины должны зависеть от количества данного вещества в системе, которое может изменяться в ходе процесса. Например, в замкнутой системе при протекании химической реакции уменьшается количество исходных веществ и увеличивается количество продуктов при сохранении общей массы вещества (меняется качественный и количественный состав системы). Для учета влияния этого обстоятельства на величины термодинамических функций было введено понятие химического потенциала.
Приращение внутренней энергии системы при увеличении количества данного вещества в условиях постоянства энтропии системы и ее объема, при постоянстве количеств остальных веществ, получило название химический потенциал i-го вещества:
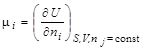 .
.
Можно показать, что величина химического потенциала i-го вещества определяется изменением термодинамической функции при изменении количества данного вещества на один моль в процессах, протекающих при постоянстве соответствующих параметров и неизменном количестве остальных веществ:
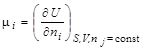
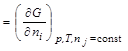
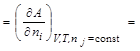
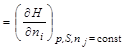 .
.
В изобарно-изотермических процессах изменение энергии Гиббса при изменении количества i-го вещества будет определяться выражением dG =mi×dni. При протекании химической реакции изменяются количества всех веществ, участвующих в реакции, поэтому dG =Smi×dni.
Условием равновесия химической реакции, происходящей в изобарно-изотермических условиях, DrG =0, следовательно, Smi×dni = 0. Для реакции nаA + nbB = nсC + ndD условием равновесия будет Smi×ni = 0,
(mc×nC + md×nD)–(ma×nA + mb×nB)=0.
Очевидно, что химический потенциал i-го вещества будет зависеть от его количества в единице объема – от концентрации вещества. Эту зависимость можно получить, рассмотрев изменение энергии Гиббса при изобарно-изотермическом смешивании двух идеальных газов.
Пусть два идеальных газа, находящихся в стандартных условиях, разделены перегородкой и занимают объемы V1 и V2 соответственно (рис.1.5). Количество первого газа равно одному молю (n1=1), а второго n2. Если убрать перегородку, происходит смешивание газов в результате взаимной диффузии. Каждый газ займет весь объем системы, и объем каждого составит V1 + V2. При этом концентрация каждого газа (количество вещества в единице объема) уменьшится. Каждый газ совершит работу расширения при постоянном давлении и температуре. Очевидно, что в результате этого процесса энергия Гиббса системы уменьшится на величину совершенной работы расширения.
 |
Рис. 1.5. Смешивание двух идеальных газов в изобарно-изотермических условиях
в результате взаимной диффузии
Изменение энергии Гиббса в результате уменьшения концентрации первого газа будет равно его работе расширения. Работа расширения первого газа определяется следующим образом:
dA = p0×dV,учитывая, что p×V =n×R×T и n1=1,
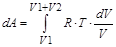 ® A =–R×T×ln
® A =–R×T×ln 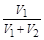 .
.
Поскольку равные объемы идеальных газов содержат одинаковое число молей вещества,
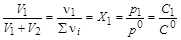 ,
,
где X1 – мольная доля 1-го газа; p1 – парциальное давление 1-го газа; р0 = 1,013×105 Па – стандартное давление; С1 – молярная концентрация 1-го газа; С0=1 моль/л стандартная концентрация.
Таким образом, энергия Гиббса 1-го газа изменится на величину DG1=R×T×lnX1. Поскольку n1=1 моль, то, очевидно, DfGi T =DfG0i T + R×T×lnXi.
Таким образом, химический потенциал вещества зависит от его концентрации в смеси:
mi =mi0 + R×T×lnXi, mi =mi0 + R×T×ln 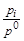 , mi =mi0 + R×T×ln
, mi =mi0 + R×T×ln 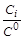 .
.
Необходимо отметить, что данные концентрационные зависимости химического потенциала характеризуют идеальные газы и растворы. Межмолекулярные взаимодействия в реальных газах и растворах приводят к отклонению расчетных химических потенциалов от величин, полученных для идеальных систем. Для учета этого вводятся понятия фугитивности иактивности.
Фугитивность f (летучесть) – термодинамическая величина, служащая для описания свойств реальных газовых смесей. Она позволяет применять уравнения, выражающие зависимость химического потенциала идеального газа от температуры, давления и состава системы. При этом парциальное давление компонента газовой смеси pi заменяется на его фугитивность fi. Межмолекулярное взаимодействие приводит к уменьшению значения эффективного парциального давления компонента газовой смеси. Для учета этого величина парциального давления умножается на коэффициент фугитивности (gi<1).Очевидно, что при pi®0 gi®1 и fi ® pi.
В отличие от идеальных, в реальных растворах имеются межмолекулярные взаимодействия и взаимодействия между ионами, образующимися в результате электролитической диссоциации. Это приводит к тому, что эффективная концентрация молекул и ионов в реальных растворах уменьшается. Поэтому при вычислении химического потенциала используют вместо концентрации С величину активности а. Активность и молярная концентрация i-го компонента связаны соотношением аi =gi×Сi, где gi – молярный коэффициент активности (gi<1). Очевидно, что при Сi®0 gi®1 и аi ® Сi.
Дата добавления: 2020-02-05; просмотров: 867;











