Неорганические вещества клетки.
Химические элементы входят в состав клетки в виде ионов и молекул неорганических и органических соединений. Важнейшие неорганические вещества в клетке – вода и минеральные соли.
Вода –преобладающий компонент всех живых организмов.
Среднее содержание воды в клетке многоклеточного организма около 70-80%.
Содержание воды в клетке различного типа:
10% - клетки эмали зубов; 20% - кости; 90% - клетки развивающегося зародыша (до 97%); 85% - нервные клетки; 10-20% - покоящиеся клетки и ткани (споры, семена). Содержание воды в организме зависит от его возраста и метаболической активности.
Вода в клетках находится в 2х формах:
1) свободная вода – составляет 95% всей воды в клетках – универсальный растворитель.
2) связанная вода – 4-5% всей воды клеток – дипольный характер строения воды позволяет ей формировать вокруг белков водную оболочку, препятствующую склеиванию друг с другом.
По отношению к воде все вещества делятся на:
ü гидрофильные (водорастворимые) – минеральные соли, кислоты, щелочи, моносахариды, белки.
ü гидрофобные (водонерастворимые) – жиры, полисахариды, некоторые соли и витамины и др.
Кроме воды растворителями могут быть жиры и спирты.
Свойства и функции воды:
1) вода – растворитель.
Большинство химических реакций, обеспечивающих жизнедеятельность клеток, протекают в водной среде. Проникновение веществ в клетки и выведение из нее продуктов диссимиляции в большинстве случаев возможно только в растворенном виде.
2) вода участвует во многих химических реакциях в клетке.
Реакция гидролиза – взаимодействие веществ с водой. Гидролизу могут подвергаться: соли, углеводы, белки, жиры и т.д.
3) выполняет транспортную функцию.
Вместе с водой растворенные в ней вещества передвигаются к различным частям организма; ненужные продукты обмена выводятся наружу.
4) выполняет функцию терморегулятора и термостабилизатора.
Эти функции связаны с высокой теплоемкостью воды, позволяющей смягчать влияние на организм значительных внешних перепадов температуры. Высокая теплопроводность воды позволяет организму поддерживать одинаковую температуру во всем объеме.Высокая теплота испарения воды способствует охлаждению организма при перегреве. Пример: потоотделение у млекопитающих; тепловая одышка у собак в жаркую погоду.
5) для воды характерно высокое поверхностное натяжение.
6) вода источник кислорода и водорода в световую фазу фотосинтеза.
7) Вода – осмотический регулятор – принимает участие в явление осмоса, играющего важную роль в поддержание постоянства химического состава клетки.
Осмос– проникновение молекул растворителя через полупроницаемую мембрану, в раствор какого-либо вещества.
Полупроницаемыми называются мембраны, которые пропускают молекулы растворителя, но не пропускают молекулы (ионы) растворенного вещества. Давление, с которым вода проникает через мембрану, называется осмотическим. Величина его увеличивается с увеличением концентрации раствора.
Два раствора с одинаковым осмотическим давлением, независимо от химического состояния растворенных веществ, называется изотоническим (от греч. «изос» - равный и лат. «тонус» - напряжение, сила). Осмотическое давление жидкости организма человека = 0,9% раствору хлорида натрия. Более концентрированные растворы называются гипертоническими, менее – гипотоническими.
Пример:
ü если клетку поместить в гипотонический раствор, то снаружи концентрация воды будет значительно выше, чем внутри следовательно вода поступает внутрь клетки и при этом мембрана избирательно пропускает только молекулы воды. Например, эритроциты поместить в гипотонический раствор, вода будет поступать в них, давление ее на наружную клеточную мембрану будет повышаться до тех пор, пока клеточная оболочка не лопнет.
ü в гипертоническом растворе (более концентрированном извне) вода под воздействием осмотических сил выходит их клетки; эритроциты сморщиваются, обезвоживаются; а в растительных клетках наблюдается уменьшение вакуоли и цитоплазма отстает от клеточной стенки (явление плазмолиза). Это явление лежит в основе завядания растений
ü опыт с эритроцитом.
На явлении осмоса основаны движение воды по проводящей системе растений от корней к листьям и напряжение стенок растений клеток – тургор. Проникая в клетки через мембраны и создавая в них повышенное давление, вода придает упругость (тургор) листьям, лепесткам цветков, стеблям трав.
У одноклеточных организмов, обитающих в пресной воде, для удаления поступающей в клетки воды существует специальный органоид – сократительная вакуоль. У морских простейших ее нет вследствие изотоничности цитоплазмы и окружающей среды.
Свойства воды связаны с малыми размерами молекул воды, их полярностью и способностью соединения друг с другом водородными связями.
Вода – молекула полярная.
Дипольный характер строения молекул воды объясняет ее способность активно вступать во взаимодействия с различными веществами, обуславливает хорошую растворимость в ней веществ с ионной и ковалентной связью и вызывает их диссоциацию.
Диссоциация – разделение на ионы, из которых состоит данное вещество.
Сольваты (гидраты) – комплексы, образованные частицами растворенного вещества и окружающих их частицами растворителя (водой).
Минеральные соли в клетках находятся в диссоциированном виде (в твердом).
Из наиболее важных следует назвать: катионы - 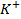 ,
, 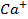 ,
, 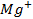 ,
, 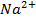 ,
, 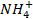 и анионы -
и анионы - 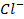 ,
, 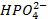 ,
, 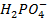 ,
, 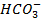 .
.
Свойства солей:
· влияют на постоянство внутренней среды клетки и организма, обеспечивая кислотно-щелочное равновесие (буферность).
· влияют на осмотическое давление, поступление воды в клетку.
· активируют ферменты.
Буферность – способность клетки поддерживать слабощелочную реакцию своего содержимого на постоянном уровне.
Пример:
ü 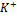 ,
, 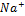 ,
, 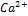 - обеспечивают раздражимость клетки.
- обеспечивают раздражимость клетки.
ü нерастворимые соли Ca и Р обеспечивают прочность костной ткани, и раковины моллюсков.
ü Са-ионы – принимают участие в свертываемости крови;
Другие элементы входящие в минеральные соли см. в таблице 1.
Содержание катионов и анионов в клетке и в окружающей среде различно благодаря полупроницаемости мембраны. Например в цитоплазме клеток много К и мало Nа. Во внеклеточной среде (плазма крови, межклеточная жидкость, в морской воде) наоборот.
Дата добавления: 2016-06-15; просмотров: 3540;











