Энергия Гиббса регулярного раствора
(реального раствора)
Регулярным называется раствор, удовлетворяющий следующим условиям:
1) размеры частиц практически одинаковы;
2) энергии взаимодействия между одноимёнными и разноимёнными частицами не равны: 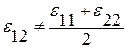 .
.
Требованиям регулярного раствора отвечает большой класс реальных растворов. Образование регулярного раствора сопровождается тепловым эффектом. Однако различие в энергиях связи должно быть небольшим, чтобы энергии теплового движения было достаточно для исключения какого-либо упорядочения частиц в растворе. Поскольку упорядоченности частиц нет, то изменение энтропии при смешении компонентов регулярного раствора находят так же, как для идеального раствора. Учтём тепловой эффект при образовании регулярного раствора.
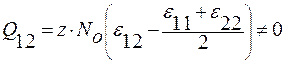 ; ΔHр-р = Q12∙N1∙N2 .
; ΔHр-р = Q12∙N1∙N2 .
ΔGр-р = ΔНр-р – Т∙ΔSр-р; ΔGр-р = Gр-р – Gисх.
Gр-р = Gисх – Т∙ΔSр-р + ΔНр-р .
В соответствии с прежними обозначениями: Gр-р = а + b + c;
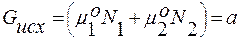 – стандартные состояния компонентов регулярного и идеального растворов совпадают.
– стандартные состояния компонентов регулярного и идеального растворов совпадают.
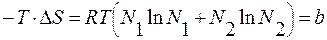 ;
;
ΔHр-р = Q12∙N1∙N2 = c.
Энергия Гиббса регулярного раствора составит:
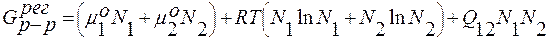 .
.
В отличие от энергии Гиббса идеального раствора, появляется третье слагаемое, представляющее собой тепловой эффект ΔHр-р при образовании реального раствора: Q12∙N1∙N2 = c.
Выделяют два случая:
1. Q12 < 0; c < 0; 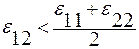 .
.
Связи в растворе слабее, чем в чистых компонентах (рис.3.30).
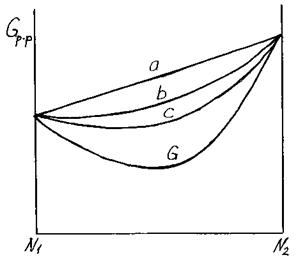
Рис. 3.30. Изменение энергии Гиббса при относительно
слабом взаимодействии разноимённых компонентов
Система устойчива, гомогенна, ликвация (фазовое разделение) невозможна. Имеем один минимум, устойчивому состоянию отвечает один раствор.
2. Q12 > 0; c > 0; 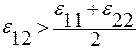 .
.
В растворе связи разноимённых частиц сильнее по сравнению с взаимодействием чистых компонентов. В расплаве возникают области, в которых преобладают разноимённые связи (рис. 3.31).
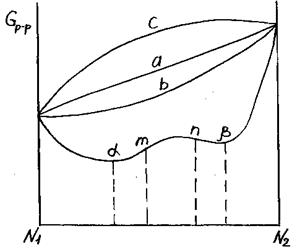
Рис. 3.31. Изменение энергии Гиббса раствора с составом при образовании прочных контактов разноимённых частиц
Термодинамически устойчивым состоянием в случае формирования в растворе связей более прочных, чем в чистых компонентах, оказывается фазовое разделение исходного расплава на две жидкости. Их составы определяются температурой и концентрацией исходного расплава. Исходная жидкость распадается на две жидкие фазы, обогащённые разными компонентами.
α и β – точки минимума, соответствующие равновесным составам фаз после ликвации.
m и n – точки перегиба линии зависимости Gр-ра =Gр-ра(N2).
Критические параметры находятся из соотношений:
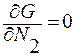 – определяем координаты точек минимума α, β;
– определяем координаты точек минимума α, β;
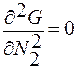 – находим положение точек перегиба m, n.
– находим положение точек перегиба m, n.
Кривые G = G (N2) строятся для разных температур и по положениям точек α и β находят область расслаивания (рис. 3.32).
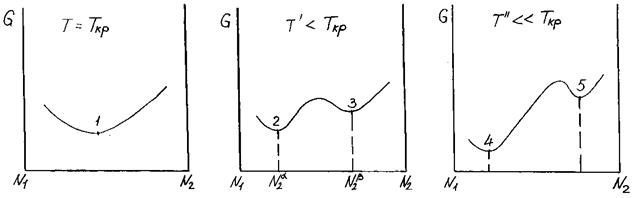
Рис. 3.32. Влияние температуры на зависимость энергии Гиббса от состава бинарного расплава
По полученным данным строим график зависимости T=T(N2), называемый куполом ликвации (рис. 3.33).
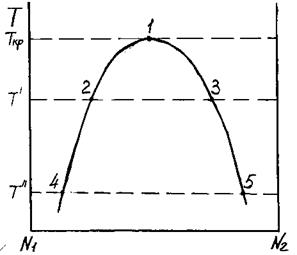
Рис. 3.33. Купол ликвации в двойной системе
Дата добавления: 2018-11-26; просмотров: 1041;











