Стабильная и метастабильная ликвации
Ликвация – жидкостное фазовое разделение или жидкостная несмешиваемость. В жидкости возникают две фазы. В гомогенной жидкости разделение может произойти, если суммарная энергия разделившихся фаз меньше энергии исходной фазы.
Причиной ликвации является неоднородное строение исходной фазы. Микронеоднородности могут быть вызваны:
1) разной концентрацией компонентов;
2) различным координационным состоянием катионов;
3) структурной неоднородностью;
4) различием энергий связи частиц и т.д.
Различают стабильную и метастабильную ликвации.
|
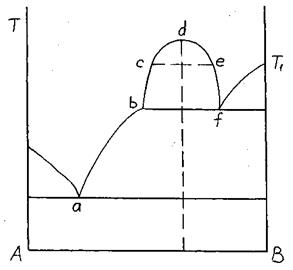
Стабильная ликвация наблюдается при температурах выше температуры ликвидуса. При снижении температуры ниже критической исходный расплав распадается на две фазы (рис. 3.26).
Рис. 3.26. Диаграмма состояния двойной системы
со стабильной ликвацией
Линия bcd характеризует состав одной фазы;
Линия def показывает состав второй фазы.
При температуре ниже уровня линии bf имеем расплав состава ab и кристаллы чистого компонента В.
Вязкость расплавов при больших температурах, как правило, низка и гетерофазная система из двух фаз быстро разделяется на два слоя – расслаивается. Сверху собирается жидкость с меньшей плотностью.
|
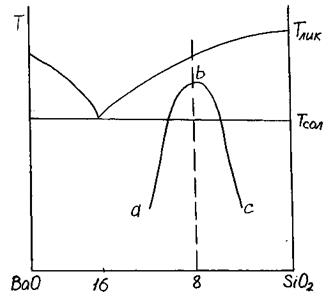
В системах, склонных к стеклообразованию, закономерности жидкостного фазового разделения в жидкостях, находящихся в метастабильном состоянии, должны быть такими же, как в надликвидусной области. В подликвидусной области фазовое разделение может наблюдаться даже в том случае, если в системе отсутствует стабильная ликвация. Метастабильная ликвация наблюдается при температурах ниже температуры солидуса (рис. 3.27).
Рис. 3.27. Метастабильная ликвация в системе BaO – SiO2
При Т<Ткр система распадается на две фазы:
ab — состав одной фазы;
bc — состав второй фазы.
Ликвидусная кривая может иметь над областью метастабильноq ликвации характерный изгиб, проявляющийся, например, на фазовой диаграмме двухкомпонентной системы Na2O-SiO2.
С точки зрения термодинамики между стабильной и метастабильной ликвациями нет различий. Однако кинетика явлений сильно различается. Разделение на две фазы связано со взаимным перемещением компонентов расплава. Из-за более низких температур скорость фазового разделения для метастабильной ликвации на несколько порядков величины ниже, чем для стабильной ликвации. Метастабильная ликвация приводит не к расслаиванию, а к фазовому разделению. В этом случае двухфазное стекло представляет микронеоднородный материал, состоящий из двух равномерно распределённых относительно друг друга разных веществ с различными свойствами.
Диаметр дисперсных образований составляет несколько десятков и сотен, редко – тысяч нанометров. Форма частиц зависит от состава и механизма распада. Из-за малых размеров фазовых образований двухфазное стекло может быть полностью прозрачным или лишь слегка опалесцирующим.
Силикатное стекло будет гомогенным только в тех случаях, если отдельные структурные элементы согласуются между собой и способны образовывать непрерывную гомогенную структуру. Структуроопределяющим элементом в силикатных стёклах является тетраэдр SiO4. Другие катионы также стремятся окружить себя определённым количеством атомов кислорода, т.е. создать характерную для данного элемента кислородную оболочку (МеОх – кислородные полиэдры).
Если по размерам и кристаллохимическим характеристикам тетраэдры SiO4 и полиэдры МеОх могут образовывать непрерывную структуру, то стекло останется гомогенным. Способность образовывать полиэдры МеОх связана с прочностью связей Ме-О. Чем прочнее связь, тем ярче выражено стремление катионов окружить себя независимой кислородной оболочкой и тем ярче выражено стремление к ликвации. Количественно прочность связи можно выразить отношением заряда катиона к его радиусу – это ионный потенциал (Z/rк) (табл. 3.2).
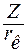 – ионный потенциал;
– ионный потенциал; 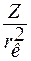 – сила поля катиона.
– сила поля катиона.
Таблица 3.2
Ионный потенциал некоторых компонентов
| Вид ликвации | Катион | Z/rк |
| Нет ликвации | Cs, Rb, K | 0,61÷0,75 |
| Метастабильная ликвация | Na, Li, Ba | 1,02÷1,40 |
| Стабильная ликвация | Sr, Ca, Mg | 1,57÷2,5 |
Дата добавления: 2018-11-26; просмотров: 1172;











