Энергия Гиббса идеального раствора
Раствор называется идеальным, если:
1) размеры всех частиц одинаковы;
2) энергия взаимодействия одноименных и разноименных частиц совпадают.
ε11 = ε22 = ε12; Q12 = 0; ΔU = 0; ΔV = 0; ΔH = 0;
ΔG = ΔH – TΔS = – TΔS;
Изменение энергии Гиббса при образовании идеального раствора обусловлено только изменением энтропии.
Найдём изменение энтропии при образовании идеального раствора ΔSид.р-ра.
М1 – число молекул первого компонента.
М2 – число молекул второго компонента.
No – число Авагадро.
n1 = M1/Nо – число молей первого компонента.
n2 = M2/Nо – число молей второго компонента.
S1o и S2o – молярные энтропии чистых компонентов.
Sисх = n1S1o + n2S2o = k∙lnWисх.
Sр-ра = n1S1o + n2S2o + ΔSсмеш = k∙lnWр-ра.
S = k∙lnW; 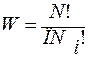 ; ΔS = ΔSр-ра – ΔSисх.
; ΔS = ΔSр-ра – ΔSисх.
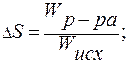
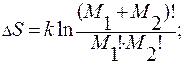
(М1+М2)! – общее число перестановок частиц. Делением на произведение М1!∙М2! исключаются перестановки одинаковых частиц.
Воспользуемся формулой Стирлинга (справедливой для больших чисел):
lnx! = x∙lnx – x.
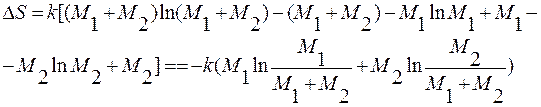 ;
;
М1 = n1∙No; М2 = n2∙No; n – число молей; k∙No = R;
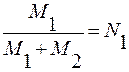 ;
; 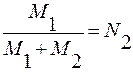 ;
;
ΔS = - R∙(nl∙lnN1 + n2∙lnN2);
ΔS > 0, так как N1<1 и N2<1;
Sр-ра = n1S1o + n2S2o - R∙(nl∙lnN1 + n2∙lnN2);
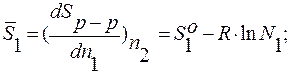
Hр-р = n1H1o + n2H2o ; 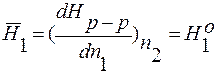 ;
;
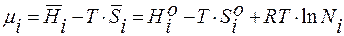 ;
;
Для идеального раствора: 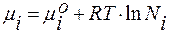 ;
;
В общем случае:
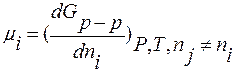 ;
; 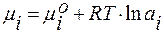 ;
;
Для идеального раствора активность компонента равна его мольной доле: ai= Ni. Найдём энергию Гиббса идеального раствора:
Gp-p= μ1∙N1 + μ2∙N2 ;
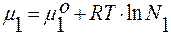 ;
; 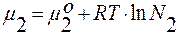 ;
;
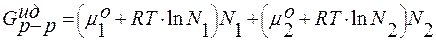 ;
;
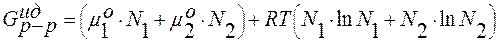 ;
;
Слагаемое 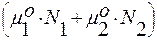 = а – меняется линейно с составом раствора (рис. 3.29).
= а – меняется линейно с составом раствора (рис. 3.29).
Слагаемое 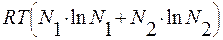 = b < 0 и расположено, следовательно, ниже зависимости а = а (N2).
= b < 0 и расположено, следовательно, ниже зависимости а = а (N2).
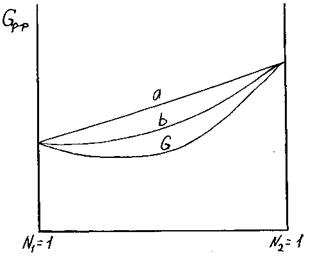
Рис. 3.29. Изменение с составом энергии Гиббса
идеального раствора
При образовании идеального раствора на зависимости Gp-p = f (N2) выявляется один минимум, соответствующий устойчивому состоянию (или составу) системы. Поэтому ликвация – равновесное сосуществование двух различных растворов, в данном случае невозможна.
Дата добавления: 2018-11-26; просмотров: 1544;











