Кинетика объемной кристаллизации стёкол
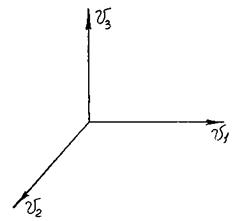
Кристаллизация распространяется по всему объему стекла. Каждый зародыш растет в трех направлениях (рис. 3.20).
vi – линейная скорость роста зародыша по i-й оси координат;
|
Рис. 3.20. Скорости роста зародыша в трёхмерном
пространстве
li – размер i-го ребра: 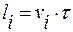 .
.
v – объём элементарного кристаллика: 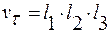 .
.
Объем кристалла в любой момент времени составит:
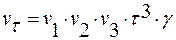 ,
,
γ – коэффициент формы кристалла;
Обозначим через n концентрацию зародышей: n – количество зародышевых центров в единице объёма стекла
VΣ — суммарный объем кристаллической фазы.
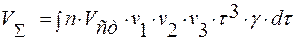 ;
;
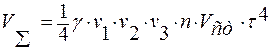 ;
;
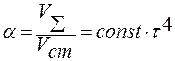 .
.
|
α – относительный объём кристаллической фазы.
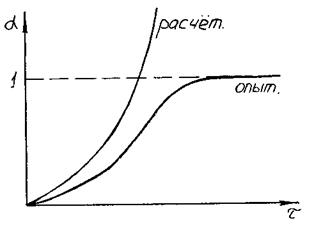
Рис. 3.21. Увеличение со временем доли кристаллической фазы
при объёмной кристаллизации стекла
Расчётная зависимость выполняется только в начальный период кристаллизации (рис. 3.21), так как в реальности существуют неучтённые ограничения процесса:
1. Выводы справедливы для отдельных кристаллов без учёта их возможного влияния друг на друга.
2. Объём кристаллической фазы не может превышать объёма стеклофазы и, следовательно, при Vкр → Vст величина α →1.
Кристаллы, разрастаясь в объёме расплава, приходят в соприкосновение. Это приводит к искажению поверхности кристалла. Дальнейший рост кристалла в этом направлении прекращается. По мере роста кристаллов, они заполняют весь объём стекла, и постепенно доля кристаллической фазы α приближается к единице.
Объёмная кристаллизация характерна для относительно маловязких стеклующихся расплавов. Опытная зависимость, полученная, например, для фосфатных стёкол, хорошо описывается уравнением Авраами:
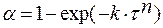 ,
,
k, n — постоянные, определяемые природой стекла.
При объёмной кристаллизации зародышеобразование может быть гомогенным, гетерогенным или фотонуклеационным.
3.3. Кристаллизация при получении специальных стекол
Для регулирования процесса кристаллизации вводят катализаторы.
Требования к катализаторам:
1. Катализатор должен иметь неограниченную растворимость в стекле при температурах варки и выработки и ограниченную растворимость при температуре стеклования Tg.
2. Катализатор должен уменьшать энергию активации процесса образования центров кристаллизации.
3. Ионы и атомы катализатора должны иметь повышенную скорость диффузии при низких температурах по сравнению с основными компонентами стекла.
4. Граница «зародыш кристалла-стекло» должна иметь низкую межфазную энергию, чтобы обеспечить хорошую смачиваемость.
По механизму действия катализаторы делят на две группы: активные и коллоидные.
1. Активные катализаторы, растворённые в стекле, при охлаждении выделяются в виде атомарных или молекулярных группировок и вызывают появление микронеоднородностей, переходящих в ликвацию или кристаллизацию основного стекла. Параметры решёток катализатора и выделяющейся кристаллической фазы могут различаться не более чем на 10-15 %. К активным катализаторам относят оксиды TiO2, Cr2O3 и другие.
2. Коллоидные катализаторы. Кристаллизация протекает при восстановлении катионов некоторых металлов: Cu, Au, Ag, Pt и других. Процесс сводится к восстановлению их в стекле до чистых металлов и последующей коагуляцией частиц до коллоидных размеров. Для интенсификации процесса восстановления в стекло вводят сенсибилизаторы (лат. sensibilities — чувствительный), которые выступают в роли катализаторов. В качестве сенсибилизаторов используются оксиды SnO, Sb2O3, Ce2O3 и другие.
Примеры получения цветных стёкол:
1. Медный рубин: стекло + CuO (0,1÷1,0%).
При большой температуре 4CuO →2Cu2O + O2;
Cu2O = 2Cu+ + O2- ;
2Cu+ + Sn2+ = 2Cuo + Sn4+ .
При температуре отжига параллельно производят наводку окраски стекла (красный цвет).
2. Золотой рубин: стекло + AuCl3 (0,0001÷0,1%).
При высокой температуре (III) хлорид золота диссоциирует на ионы
AuCl3 → Au3+ + 3Cl-
2Au3+ + 3Sb3+ = 2Auo + 3Sb5+
Окраска наводится также при отжиге (красный золотой рубин).
Фотоситаллы: получают облучением стёкол ультрафиолетовыми или рентгеновскими лучами. При облучении одновалентные катионы Cu+, Au+, Ag+, Pt+ переходят в атомарное состояние. Процесс протекает в две стадии:
1) стадия облучения;
2) стадия проявления.
Реакция сенсибилизации золота Au+:
Au+ + Сe3+ + hν = Ce4+ + Auo + ω,
ω – избыточная энергия, выделяемая в виде инфракрасного или светового излучения.
Реакция самосенсибилизации меди Cu+:
2Cu+ + hν = Cu2+ + Cuo + ω.
В результате облучения в стекле появляются фотоэлектроны, испускаемые светочувствительными катионами металлов. Фотоэлектроны локализуются вблизи катионов металлов и структурных дефектов. Создаётся скрытое изображение, устойчивое при низких температурах. У термоситаллов кристаллизация осуществляется при температурной выдержке. При этом атомы восстановленного металла объединяются в кристаллы коллоидных размеров.
3.4. Выбор режима отжига при получении ситаллов
|
Ситалл – искусственный материал микрокристаллического строения, полученный методом направленной кристаллизации из стекла соответствующего состава и обладающий по сравнению с этим стеклом более высокими физико-химическими свойствами. Размер кристаллов в ситаллах, как правило, не более 1-2 мкм и находится обычно в пределах 0,02-1,00 мкм.
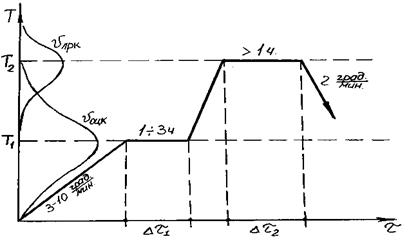
Процессом кристаллизации в стёклах управляют, используя знание температур, при которых максимальны скорость образования центров кристаллизации vоцк и скорость линейного роста кристаллов vлрк (рис. 3.22).
Рис. 3.22. Схема термообработки стекла
с целью получения ситаллов
Примеры:
1. Для пайки отдельных частей кинескопов применяют ситаллы на основе системы
PbO–ZnO–B2O3–SiO2 + смесь оксидов (P2O5, MoO3, WO3)
Смесь компонентов (2-х и более) используется для регулирования порядка выпадения кристаллических фаз.
На первом этапе отжига должно образоваться необходимое количество центров кристаллизации. Продолжительность первого этапа определяется временем достижения необходимой концентрации кристалликов.
На втором этапе создаются условия для превращения стекла в поликристаллический материал. Продолжительность этапа определяется требованиями к свойствам ситаллов. Чем длительнее выдержка на каждом этапе, тем в большей степени свойства стекла будут дополняться свойствами кристаллической фазы.
Если Δτ1 > Δτ2 – формируется множество мелких дисперсных кристалликов, рассредоточенных по стекломатрице.
Если Δτ1 < Δτ2 – получаем редкие крупные кристаллы, нарушающие структуру стекла.
2. Шлакоситаллы получают на основе доменного шлака. Хорошо изучены особенности кристаллизации в системе
MgO–Al2O3–SiO2 + 9÷10% TiO2.
Отжиг в этой системе одноступенчатый, т.к. температуры максимумов vоцк и vлрк примерно совпадают.
Т1 ≈ Т2 , Тотж = 1250–1300ºС.
Время отжига 1–16 часов.
Подбором химического состава стекла и катализаторов, а также выбором температурного режима контролируют процесс выделения кристаллической фазы. Основное требование – время отжига должно быть минимальным.
Стеклокристаллические материалы (ситаллы) обладают по сравнению с обычным стеклом рядом уникальных свойств: повышенной твердостью, термостойкостью, химической стойкостью.
Дата добавления: 2018-11-26; просмотров: 1101;











