Образовалось в соответствии с заданным мольным соотношением
НСООН : СО2 : СО : СН4 = 1,8 : 1,6 · 0,1 : 0,3 (всего 3,8)
НСООН ……………………. 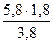 = 2,75 кмоль или 126,5 кг
= 2,75 кмоль или 126,5 кг
СО2 ………………………….  = 2,45 кмоль или 108 кг
= 2,45 кмоль или 108 кг
СО …………………………..  = 0,158 кмоль или 4,3 кг
= 0,158 кмоль или 4,3 кг
СН4 …………………………. 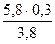 = 0,459 кмоль или 7,3 кг
= 0,459 кмоль или 7,3 кг
Для определения количества водяного пара и водорода в газах синтеза составляется баланс по кислороду и водороду.
Баланс по кислороду.
В реактор поступило кислорода (в кг):
С воздухом………. 586
В составе СН3ОН…… 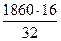 = 930
= 930
______________________________
Всего: 1516 кг
где 32 – мол. масса СН3ОН; 16 – ат. масса О2.
Израсходовано кислорода:
на образование СН2О
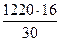 = 650 кг
= 650 кг
на образование НСООН
 = 88 кг
= 88 кг
на образование СО2
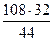 = 78,6 кг
= 78,6 кг
на образование СО
 = 2,45 кг
= 2,45 кг
В составе неокисленного метанола:
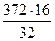 = 186 кг
= 186 кг
Всего израсходовано кислорода:
650 + 88 + 78,6 + 2,4 + 186 = 1005 кг
Остальное количество кислорода, равное 1516 – 1005 = 509 кг, пошло на образование воды по реакциям (1), (3), (5), (6), и (7).
В результате получено
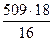 = 572 кг Н2О
= 572 кг Н2О
Баланс по водороду. Количество водорода, поступающего в реактор:
 = 233 кг Н2
= 233 кг Н2
Расходуется водорода:
на образование СН2О
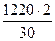 = 81,5 кг
= 81,5 кг
на образование НСООН
 = 5,5 кг
= 5,5 кг
на образование СН4
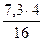 = 1,82 кг
= 1,82 кг
на образование Н2О
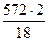 = 63,6 кг
= 63,6 кг
В составе неокисленного СН3ОН:
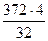 = 46,5 кг Н2
= 46,5 кг Н2
Всего расходуется водорода: 81,5 + 5,5 + 1,82 + 63,6 + 46,5 = 198,92 кг.
Остальное количество водорода входит в состав контактных газов в свободном состоянии 233 – 198,92 = 34,08 кг.
Результаты расчетов сведены в таблицу:
Дата добавления: 2021-12-14; просмотров: 551;











