РАВНОВЕСИЕ ХИМИКО-ТЕХНОЛОГИЧЕСКИХ ПРОЦЕССОВ
Наряду с химическим взаимодействием между исходными веществами – прямой реакцией происходит химическое взаимодействие и между продуктами реакции, т.е. обратимая реакция.
По мере протекания процесса скорость прямой реакции уменьшается, в то время как скорость обратной реакции увеличивается. При равенстве этих скоростей наступает химическое равновесие, неизменное при постоянных условиях – концентрации реагентов, температуре и давлении.
Согласно закону действующих масс для реакций
mА + nB ⇄ pC + qD
скорость прямой реакции
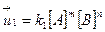
и скорость обратной реакции
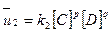
В состоянии равновесия отношение
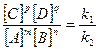 или
или 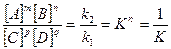 (3.2)
(3.2)
где К – константа равновесия, значение которой для данной реакции изменяется в зависимости от температуры.
Зависимость константы равновесия от температуры определяется по уравнению Вант-Гоффа:
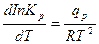 (3.3)
(3.3)
где qp – тепловой эффект реакции; температурная зависимость которого определяется из уравнения Кирхгофа.
Для расчета зависимости константы равновесия от температуры подставляем в уравнение (3.2) значение qp = f(T) и получаем после интегрирования степенной ряд, заканчивающийся постоянной интегрирования.
В зависимости от того, в каких единицах выражены концентрации реагентов – исходные и конечные – константа равновесия может быть определена по следующим уравнениям:
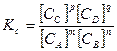 (3.4)
(3.4)
В уравнении (3.4) концентрации выражены моль/дм3, кмоль/м3.
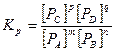 (3.5)
(3.5)
Здесь концентрации выражены в парциальных давлениях, Па, кН/м2.
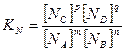 (3.6)
(3.6)
В уравнении (3.6) концентрации выражены в % (мол. или об.). Между Кс, Кр, КN существует зависимость
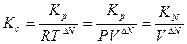 (3.7)
(3.7)
где DN = v1 – v2, а v1 = q + p; v2 = m + n; R – газовая постоянная.
Можно также рассчитать константы равновесия в условиях высоких давлений, исходя из летучестей компонентов. Отклонение реальных газов от состояния идеальных при высоких давлениях может характеризоваться величиной активности вещества.
Активность вещества определяет энергию Гиббса моля вещества, переходящего из стандартного состояния в равновесное. Коэффициент активности вещества g пропорционален летучести f.
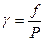
При низких давлениях можно приравнять летучесть к давлению. Летучесть характеризует отклонение реального газа от идеального состояния. Для реальных газов можно в уравнение идеального газа вместо давления подставлять значения летучести. Значение коэффициента активности газа g зависит также от коэффициента сжимаемости газов с:
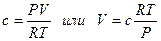
Для реальной системы при давлениях больше (30-40) × 104 Па константа равновесия может быть выражена как
Кf = КgР (3.8)
Коэффициент Кf не зависит от давления, коэффициент же Кр для равновесной смеси реальных газов зависит от давления и по мере уменьшения его стремится к значениям Кf, поскольку снижение давления означает приближение к идеальному состоянию.
Для реакции синтеза аммиака
N2 + 3H2 ⇄ 2NH3
Константы равновесия Кр и Кf могут быть представлены уравнением:
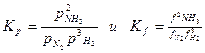 (3.9)
(3.9)
Значение константы равновесия зависит от вида стехиометрического уравнения реакции. Так, взяв для синтеза аммиака уравнение реакции вида
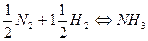
получим иную величину константы равновесия:
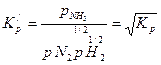 (3.10)
(3.10)
Если написать уравнение диссоциации
2NH3 ⇄ N2 + 3H2
то
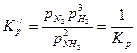 (3.11)
(3.11)
Возможны различные варианты написания одной и той же реакции и различные числовые значения константы одного и того же равновесия. Поэтому необходимо, чтобы запись числового значения константы равновесия сопровождалась записью соответствующих уравнений реакций и константы равновесия.
Пример 3.7.Найти при t = 327°С константу равновесия реакции гидрирования исходного вещества пропилена до конечного продукта пропана
С3Н6 + Н2 ⇄ С3Н8
Решение.Обозначая через ΔН° изменение энтальпии для стандартной реакции, протекающей при Р = 1,01·105 Па и абсолютном нуле, можно записать, что
ΔG° = ΔG° - ΔН°0 + ΔН°0
или
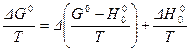
Из этого уравнения видно, что для расчета равновесия необходимо знать величину 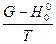 для всех реагентов и тепловой эффект реакции ΔН0° при абсолютном нуле.
для всех реагентов и тепловой эффект реакции ΔН0° при абсолютном нуле.
Значения 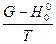 определяются на основании спектроскопических данных, а ΔН0° - по калориметрическим данным. Кроме того, для этих величин имеются расчетные уравнения, на основе которых составлены таблицы.
определяются на основании спектроскопических данных, а ΔН0° - по калориметрическим данным. Кроме того, для этих величин имеются расчетные уравнения, на основе которых составлены таблицы.
Используя табличные данные стандартных теплот образования веществ, по уравнению Гесса находим:
ΔН0°= 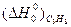 - [
- [ 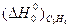 +
+ 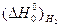 ] = -81600 – (35100 + 0) = - 116700 кДж
] = -81600 – (35100 + 0) = - 116700 кДж
при 600К
Δ 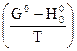 =
= 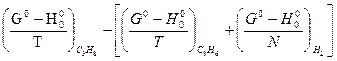 = - 264 – [( - 266) +
= - 264 – [( - 266) +
+ (-122)] = 124
RlnKp = 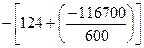 = 72
= 72
lgКр = + 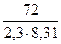 = 3,787
= 3,787
По экспериментальным данным lgКр = 3,79, что согласуется с расчетной величиной Кр = 6160 = 6,16·103.
| вариант | Параметры исходного вещества | Параметры продукта реакции | t0 С | ||||
| вещество | DН кДж/моль | DG кДж/моль | вещество | DН кДж/моль | DG кДж/моль | ||
| Этилен | 52,283 | 68,124 | Этан | -84,667 | -32,886 | ||
| 1-бутилен | -0,13 | 71,50 | Н-бутан | -126,15 | -17,15 | ||
| Пропадиен | 192,13 | 202,38 | Пропан | -103,847 | -23,489 | ||
| 1,3-бутадиен | 110,16 | 150,67 | Н-бутан | -126,15 | -17,15 | ||
| Бензол (г) | 82,927 | 129,658 | Циклогексан | -123,14 | 31,76 | ||
| Бензол (ж) | 49,028 | 124,499 | Циклогексан | -123,14 | 31,76 | ||
| Ацетилен | 226,748 | 209,200 | Этан | -84,667 | -32,886 | ||
| Транс-2-бутилен | -11,17 | 62,97 | Н-бутан | -126,15 | -17,15 | ||
| Цис-2-бутилен | -6,99 | 65,86 | Н-бутан | -126,15 | -17,15 | ||
| Этилен | 52,283 | 68,124 | Этан | -84,667 | -32,886 |
Пример 3.8. В процессе прямой гидратации исходного вещества этилена на фосфорном катализаторе (в производстве продукта реакции этанола) при t = 300°С и Р = 80·105 Па (80 ат) w = 10% (об.) этилена превращается в этанол.
Найти состав газа и условную константу равновесия, пренебрегая побочными реакциями.
Решение.По реакции:
СН2 = СН2 + Н2О ⇄ С2Н5ОН
в исходном газе (на 1 моль) содержится по 0,5 моль исходных реагентов. К моменту окончания реакции прореагировало по 0,5 · 0,1 = 0,05 моль исходных реагентов и образовалось 0,05 моль С2Н5ОН и водяного пара. Всего на 1 моль исходного газа образовалось 0,45 + 0,45 + 0,05 = 0,95 моль газа. Его состав (в % об.):
Этилен………... 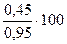 = 47,4
= 47,4
Водяной пар…………… 47,4
Этанол…………………… 5,2
__________________________ 
Итого: 100,0
Константа равновесия:
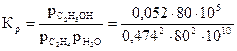 = 2,9·10-8 Па (2,9·10-3 ат)
= 2,9·10-8 Па (2,9·10-3 ат)
эту задачу можно решить и другим путем.
Для реакции А+В ® D при стехиометрическом соотношении реагентов равновесные концентрации в долях моля составляют:
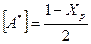 ;
; 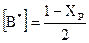 и D* = Хр
и D* = Хр
Здесь хр – равновесная степень превращения, отвечающая концентрации продуктов D в равновесном газе.
Константы равновесия
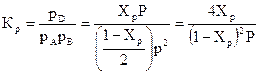
хр = 0,052, тогда
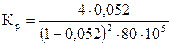 = 2,9·10-8 Па (2,9·10-3 ат)
= 2,9·10-8 Па (2,9·10-3 ат)
| вариант | Исходное вещ-во | Продукт реакции | t0 С | Р Па ×105 | w % |
| Этилен | Этанол | ||||
| Пропилен | 2-пропанол | ||||
| Изобутилен | 2-метил-2-пропанол | ||||
| Пропилен | Пропенол | ||||
| бутилен | 1-бутанол | ||||
| Этилен | Этанол | ||||
| Пропилен | 2-пропанол | ||||
| Изобутилен | 2-метил-2-пропанол | ||||
| Пропилен | Пропенол | ||||
| бутилен | 1-бутанол |
Дата добавления: 2021-12-14; просмотров: 547;











