Материальный баланс хлоратора бензола (1т хлорбензола)
| Приход | Расход | ||
| Исходное вещество | кг | продукт | кг |
| Технический бензол в том числе: С6Н6 примеси Технический хлор в том числе: Сl2 примеси | 2771,7 71,1 724,3 14,7 | С6Н5Сl С6Н4Сl2 С6Н3Сl3 С6Н6 НСl Примеси к С6Н6 Примеси к Сl2 | 15,6 372,4 71,1 14,7 |
| Итого: | 3581,8 | Итого: | 3582,8 |
| параметры | Вариант | |||||||||
| wб % | 60,5 | 61,5 | 62,5 | 63,5 | 64,5 | |||||
| wх % | ||||||||||
| wд % | 2,5 | 2,5 | 3,5 | 3,5 | 2,5 | 2,5 | 1,5 | |||
| wт % | 0,5 | 0,5 | 1,5 | 1,5 | 0,5 | 0,5 | ||||
| w1 % | 95,5 | 96,5 | 97,5 | 97,5 | 96,5 | |||||
| w2 % | 97,5 | 96,5 | 96,5 | 97,5 | 98,5 | |||||
| G т |
Пример 3.6.Составить материальный баланс реактора для каталитического окисления метанола в формальдегид. Производительность реактора G = 10000 т/год СН2О. Степень превращения СН2ОН в СН2О х1 = 0,7. Общая степень превращения метанола х2 = 0,8 (с учетом побочных реакций). Содержание метанола в спирто-воздушной смеси w – 40% (об.). Мольное соотношение побочных продуктов в продукционном газе НСООН : СО2 : СО : СН4 равно с1 : с2 : с3 : с4 = 1,8 : 1,6 : 0,1 : 0,3. Агрегат работает n = 341 день в году (с учетом планово-предупредительного ремонта и простоев). Окисление ведется на твердом серебряном катализаторе при 600°С. Расчет ведется на производительность реактора в кг/ч.
Решение. Чрезвычайная реакционная способность формальдегида обусловливает его широкое применение в качестве полупродукта в органических синтезах, особенно в производстве синтетических смол и других веществ.
Формальдегид получают главным образом окислением метанола воздухом. Процесс окисления проводят при 550 – 600°С на серебряном катализаторе. При этом одновременно протекают реакции дегидрирования метанола и его окисления:
СН3ОН + ½О2 ® СН2О + Н2О + Q (1)
СН3ОН ® СН2О + Н2 – Q (2)
Обычно на реакцию подают лишь около 80% воздуха от количества, соответствующего мольному отношению СН3ОН : О2 = 2 : 1 и проводят процесс с неполным сгоранием образовавшегося водорода по реакции
Н2 + ½О2 = Н2О + Q (3)
Выходящие из контактного аппарата газы содержат 20 – 21% формальдегида, 36 – 38% азота и примеси в виде СО, СО2, СН4, Н2, СН3ОН, НСООН и др.
Образование примесей можно представить следующим образом:
СН3ОН ® СО + 2Н2 (4)
СН3ОН + Н2 ® СН4 + Н2О (5)
СН3ОН + О2 ® НСООН + Н2О (6)
СН3ОН + 1,5О2 ® СО2 + 2Н2О (7)
Вся эта смесь после охлаждения в холодильнике до 60°С поступает в поглотительную башню, орошаемую водой. Полученный в результате поглощения раствор формалина содержит 10 – 12% метанола, который в данном случае является желательной примесью, так как препятствует полимеризации формальдегида.
Производительность реактора окисления метанола
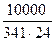 = 1220 кг/ч СН2О или
= 1220 кг/ч СН2О или 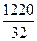 = 40,7 кмоль/ч СН2О
= 40,7 кмоль/ч СН2О
Для получения такого количества формальдегида необходимо метанола [по реакции (1) и (2) на 1 моль формальдегида расходуется 1 моль метанола]:
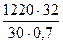 = 1860 кг или
= 1860 кг или 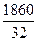 = 58,12 кмоль
= 58,12 кмоль
где 30 и 32 – мол. массы формальдегида и метанола соответственно; 0,7 – степень превращения метанола в формальдегид.
Объем паров метанола составит: 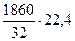 = 1300 м3.
= 1300 м3.
Объем спирто-воздушной смеси: 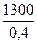 = 3250 м3.
= 3250 м3.
С ней поступает воздуха 3250 – 1300 = 1950 м3. В том числе кислорода 1950 · 0,21 = 410 м3 или 586 кг, азота 1930 · 0,79 = 1540 м3 или 1920 кг.
В состав газовой продукционной смеси входит СН2О, неокисленный СН3ОН, азот и побочные продукты: НСООН, СО, СО2, СН4, Н2, а также водяной пар.
Образуется СН2О – 40,7 кмоль. Определим какое количество метанола расходуется на образование побочных продуктов СО, СН4, НСООН и СО2. На образование одного моля любого из этих побочных продуктов по реакциям (4) – (7) расходуется по 1 моль СН3ОН.
Всего на образование побочных продуктов израсходовано метанола
58,12 · 0,8 – 40,7 = 5,8 кмоль
Остается неокисленным в составе продукционных газов:
58,12 · 0,2 = 11,6 кмоль СН3ОН или 372 кг
Дата добавления: 2021-12-14; просмотров: 573;











