И МАТЕРИАЛЬНЫЕ РАСЧЕТЫ ХИМИКО-ТЕХНОЛОГИЧЕСКИХ ПРОЦЕССОВ
Химико-технологические расчеты составляют главную, наиболее трудоемкую часть проекта любого химического производства, они же являются завершающей стадией лабораторного технологического исследования и выполняются также при обследовании работающих цехов и установок. Целью этих расчетов может быть определение кинетических констант и оптимальных параметров производства или же вычисление реакционных объемов и основных размеров химических реакторов.
Материальные расчеты, наряду с тепловыми, являются основой технологических расчетов. К ним следует отнести определение выхода основного и побочных продуктов, расходных коэффициентов по сырью, производственных потерь. Только определив материальные потоки, можно произвести необходимые конструктивные расчеты производственного оборудования и коммуникаций, оценить экономическую эффективность и целесообразность процесса.
Материальный баланс может быть представлен уравнением, левую часть которого составляет масса всех видов сырья и материалов, поступающих на переработку S G, а правую – масса получаемых продуктов S G/ плюс производственные потери Gпот:
S G = S G/ + Gпот (3.1)
Основой материального баланса являются законы сохранения массы вещества и стехиометрических соотношений.
Материальный баланс составляют по уравнению основной суммарной реакции с учетом побочных реакций согласно закону сохранения массы вещества. Общая масса всех поступающих в аппарат (или в цех) материалов, т.е. приход, равен общей массе выходящих материалов, т.е. расходу. Материальный баланс составляют на единицу массы основного продукта (кг, т) или на единицу времени (ч, сутки). Определение массы вводимых компонентов и полученных продуктов производится отдельно для твердой, жидкой и газообразной фаз согласно уравнению:
Gг + GЖ + Gт =  (3.2)
(3.2)
В процессе не всегда присутствуют все фазы, в одной фазе может содержаться несколько веществ, что приводит к упрощению или усложнению уравнения.
При составлении полного баланса обычно решают систему уравнений с несколькими неизвестными. При этом могут быть использованы соответствующие формулы для определения равновесного и фактического выхода продукта, скорости процесса и др.
Теоретический материальный баланс рссчитывается на основе стехиометрического уравнения реакции. Для его составления достаточно знать уравнение реакции и молекулярные массы компонентов.
Практический материальный баланс учитывает состав исходного сырья и готовой продукции, избыток одного из компонентов сырья, степень превращения, потери сырья и готового продукта и т.д.
Из данных материального баланса можно найти расход сырья и впомогательных материалов на заданную мощность аппарата, цеха, предприятия, себестоимость продукции, выходы продуктов, объем реакционной зоны, число реакторов, производственные потери (непроизводительный расход сырья, материалов, готового продукта на разлив, утечку, унос).
На основе материального баланса составляют тепловой баланс, позволяющий определить потребность в топливе, величину теплообменных поверхностей, расход теплоты или хладоагентов. Все эти данные записывают в виде таблицы.
Расчеты обычно выполняют в единицах массы (кг, т); можно вести расчет в молях. Только для газовых реакций, идущих без изменения объема, в некоторых случаях возможно ограничиться составлением баланса в кубических метрах.
Расходные коэффициенты – величины, характеризующие расход различных видов сырья, воды, топлива, электроэнергии, пара на единицу вырабатываемой продукции. При конструировании аппаратов и определении параметров технологического режима задаются также условия, при которых рационально сочетаются высокая интенсивность и производительность процесса с высоким качеством продукции и возможно более низкой себестоимостью.
Себестоимостью называется денежное выражение затрат данного предприятия на изготовление и сбыт продукции. Для составления калькуляции себестоимости, т.е. расчета затрат на единицу продукции – определяют статьи расхода и в том числе расходные коэффициенты по сырью, материалам, топливу и энергии и с учетом цены на них рассчитывают калькуляцию. На практике обычно чем меньше расходные коэффициенты, тем экономичнее процесс и соответственно тем меньше себестоимость продукции. Однако снижение расходных коэффициентов ниже определенного минимума связано с необходимостью повышения чистоты исходных материалов, степеней извлечения, выхода продукта, что требует значительных расходов и может повести к увеличению себестоимости продукта.
Особое значение имеют расходные коэффициенты по сырью, поскольку для большинства химических производств 60-70% себестоимости приходится на эту статью.
Для расчета расходных коэффициентов необходимо знать все стадии технологического процесса, в результате осуществления которых происходит превращение исходного сырья в готовый продукт.
Теоретические расходные коэффициенты Ат учитывают стехиометрические соотношения, по которым происходит превращение исходных веществ в целевой продукт. Практические расходные коэффициенты Апр, кроме этого, учитывают производственные потери на всех стадиях процесса, а также побочные реакции, если они имеют место.
Расходные коэффициенты для одного и того же продукта зависят от состава исходных материалов и могут значительно отличаться друг от друга. Поэтому в тех случаях, когда производство и сырье отдалены друг от друга, необходима предварительная оценка по расходным коэффициентам при выборе того или иного типа сырья с целью определения экономической целесообразности его использования.
Пример 3.1.Рассчитать расход бензола и пропан-пропиленовой фракции газов крекинга w1 = 30% (об.) пропилена и w2 = 70% (об.) пропана для производства G = 1т фенола, если выход изопропиленбензола из бензола составляет w3 = 90% от теоретического, а фенола из изопропилбензола – w4 = 93%.
Решение.Получение фенола и ацетона на основе бензола и пропилена состоит из трех стадий:
первая стадия
получение изопропиленбензола (кумола)
СН3
|
С6Н6 + СН2 = СН – СН3 → С6Н5 – СН
|
СН3
вторая стадия
окисление изопропиленбензола в гидроперекись
СН3 СН3
| |
С6Н5 – СН + О2 → С6Н5 – С – О – ОН
| |
СН3 СН3
третья стадия
разложение гидроперекиси изопропиленбензола (кипячением с Н2SO4)
СН3 СН3 СН3
| О2 | |
С6Н6 + СН2 = СН – СН3 → С6Н5 – СН → С6Н5 – С – О – ОН → С6Н5ОН + С=0
бензол | | фенол |
СН3 СН3 СН3
ацетон
а) Получение 1 кмоль фенола обеспечивает 1 кмоль бензола; таким образом, теоретический расход бензола на 1т продукта (фенола)
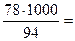 830 кг = 0,83 т
830 кг = 0,83 т
С учетом степеней превращения на стадиях процесса получим:
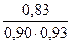 = 0,99 т бензола
= 0,99 т бензола
б) На образование 1 кмоль фенола идет 22,4 м3 пропилена, т.е. объем пропилена, необходимого для получения 1 т фенола
 = 238 м3
= 238 м3
Вместе с пропиленом будет подано пропана
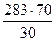 = 60 м3
= 60 м3
Всего пропан-пропиленовой фракции
283 + 660 = 943 м3
или расход:
пропилена
 = 541 кг
= 541 кг
пропана
 = 1300 кг
= 1300 кг
Всего пропан-пропиленовой фракции: 1841 кг = 1,84 т.
| параметры | Вариант | |||||||||
| w1 % | ||||||||||
| w2 % | ||||||||||
| G т | ||||||||||
| w3 % | 87,5 | 88,5 | 89,5 | 90,5 | 91,5 | |||||
| w4 % | 90,5 | 91,5 | 92,5 | 93,5 | 94,5 |
Пример 3.2.Рассчитать расходный коэффициент для природного газа, содержащего w1 = 97% (об.) метана в производстве уксусной кислоты на G = 1т из ацетальдегида. Выход ацетилена из метана составляет w2 = 15% от теоретически возможного, ацетальдегида из ацетилена w3 = 60%, а уксусной кислоты из ацетальдегида w4 = 90% (масс.).
Решение.Уксусная кислота получается из метана многостадийным методом. Схематично процесс может быть описан следующими, последовательно протекающими реакциями:
2СН4 ⇄ С2Н2 + 3Н2
С2Н2 + Н2О ⇄ СН3СНО
СН3СНО + 0,5О2 ⇄ СН3СООН
Мол. масса: С2Н2 – 26; СН3СНО – 44; СН3СООН – 60; СН4 – 16.
Теоретический расход метана на 1т уксусной кислоты составит:
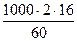 = 534 кг
= 534 кг
с учетом выхода продукта по стадиям
 = 6590 кг
= 6590 кг
или
 = 9226 м3 СН4
= 9226 м3 СН4
или
 = 9500 м3 природного газа
= 9500 м3 природного газа
| параметры | Вариант | |||||||||
| w1 % | 93,5 | 94,5 | 95,5 | 96,5 | 97,5 | |||||
| G т | ||||||||||
| w2 % | 13,5 | 14,5 | 15,5 | 16,5 | 17,5 | |||||
| w3 % | 57,5 | 58,5 | 59,5 | 60,5 | 61,5 | |||||
| w4 % | 88,5 | 89,5 | 90,5 | 91,5 | 92,5 |
Пример 3.3.Составить материальный баланс производства окиси этилена прямым каталитическим окислением этилена воздухом. Состав исходной газовой смеси в % (об.): этилен – wэ = 3, воздуха – wв = 97. Степень окисления этилена х = 0,5. Расчет следует вести на G = 1т окиси этилена.
Решение.Окись этилена является одним из важнейших полупродуктов, имеющих широкое применение в различных синтезах – для получения этиленгликоля, полигликолей, лаковых растворителей, пластификаторов, этаноламинов, различных эмульгирующих и моющих средств; соединения, синтезируемые из окиси этилена, находят применение в производстве синтетических волокон, каучуков и других продуктов.
В настоящее время применяются два основных метода получения окиси этилена:
1. Гипохлорирование этилена с последующим отщеплением хлористого водорода от получающегося этиленхлоргидрина.
2. Прямое каталитическое окисление этилена. При пропускании смеси воздуха с этиленом (нижний предел взрываемости этиленовоздушной смеси – 3,4% С2Н4) на серебряном катализаторе при 250 – 280°C образуется окись этилена:
2СН2 = СН2 + О2 = 2СН2 – СН2
\ /
О
Окись этилена из газовой смеси выделяют водной абсорбцией, а остаточный газ направляют во 2-й контактный аппарат.
По уравнению реакции находим расход этилена на 1т окиси этилена. Из 28 кг этилена образуется 44 кг С2Н4О или расход С2Н4 на 1000 кг окиси этилена составит:
 = 640 кг
= 640 кг
С учетом степени окисления:
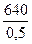 = 1280 кг или
= 1280 кг или  = 1020 м3
= 1020 м3
Объем воздуха в этиленвоздушной смеси составит
 = 33000 м3
= 33000 м3
в том числе кислорода 33000 · 0,21 = 6800 м3 или
 кг
кг
азота 33000 · 0,79 = 26200 м3 или
 кг
кг
Израсходовано кислорода на окисление
 м3
м3
В продуктах окисления содержится кислорода:
6800 – 255 = 6545 м3 или 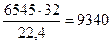 кг
кг
Результаты расчетов сведены в таблицу:
Дата добавления: 2021-12-14; просмотров: 556;











