Химическое равновесие
Химическое равновесие –этотакое ТД-состояние системы, при котором ее параметры остаются неизменными: f (P,V,T)=0. Обратимой является химическая реакция, протекающая как в прямом, так и в обратном направлениях.
Равновесие является динамическим по характеру и сохраняется во времени не вследствие прекращения (отсутствия) процесса, а вследствие равенства скоростей прямого и обратного процессов при неизменности внешних условий.
В равновесной системе устанавливается определенное, характерное для данных условий соотношение между концентрациями реагентов и продуктов.
Скорость химической реакции прямо пропорциональна концентрации реагирующих веществ. Положение равновесия можно определить, зная скорости прямой и обратной реакций. Количественная характеристика равновесия – Кр. Для любой гомогенной реакции вида
аА + bB ↔ cC + dD
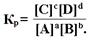
Если Кр>1, велико содержание продуктов;
если Кр<1, выход продукт мал, велико содержание реагентов.
Это критерий химического равновесия. Кр зависит от природы реагентов и Т, но не от [C] и катализатора.
Уравнение Нернста
Приравновесии (при равновесных концентрациях реагентов и продуктов) стандартное изменение свободной энергии системы определяется уравнением Нернста:
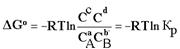
| где R – газовая постоянная, равная 8,31 Дж/(моль К), С – концентрации реагентов в моль/л (в случае реагентов в газовой фазе обычно используют Р, атм.); а, b, c, d – стехиометрические коэффициенты в уравнении реакции. |
Строгий вывод выражения связи Кр и ΔG основан на ТД-принципах:
| Amax = n· F ·E | максимальная работа для превращения 1 моль вещества под за счет силы электрического тока (в гальваническом элементе), Т,Р =const; |
| Amax = – ΔG | максимальная работа при ст.у. равна изменению стандартного изобарного потенциала реакции (4-е следствие I закона ТД); |
| – ΔG = RT ln Kр | изобарный потенциал ΔGº связан с Кр уравнением изотермы химической реакции (Дж. Гиббс). |
Для предсказания возможности протекания реакции необходимо рассчитать реальное значение ΔG (без индекса вверху, указывающего на стандартное состояние) путем добавления к ΔGо поправки, учитывающей отклонение от стандартных условий (уравнение Нернста):
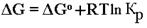
Дата добавления: 2019-12-09; просмотров: 759;











