Смещение равновесия. Принцип Ле-Шателье и уравнение Вант-Гоффа
Принцип Ле-Шателье определяет направление смещения равновесия, а уравнение Вант-Гоффа – его количественные критерии.
По мере протекания реакции и изменения концентрации реагентов ([A], [B] уменьшаются, а [C] и [D] возрастают) значение ΔG, оставаясь отрицательным, постепенно растет (а по модулю уменьшается), пока не станет равным нулю. В этом случае ни прямая, ни обратная реакции уже не имеют преимуществ, в обоих случаях ΔG=0 (при этом G≠0!)
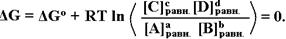
Такая «самопроизвольная остановка» реакции происходит в каждом конкретном случае при определенном соотношении С всех исходных веществ и продуктов реакции. Эти концентрации называются равновесными (а состояние системы, по определению, – равновесием).
Если на систему, находящуюся в равновесии, оказать какое-либо воздействие (изменяются Т, Р, С), то равновесие сместится в сторону уменьшения данного воздействия.
Одно из важнейших достижений ТД как раз и состоит в том, что имеется возможность теоретически рассчитать Кр при данной Т для данной реакции, если известен ее тепловой эффект ΔHо и изменение энтропии ΔSo в стандартных условиях.
Из условия равновесия ΔG=0 следует, что ΔGо+RT lnКр= 0, откуда получаем выражение для теоретического расчета Кр:
ln Kр= –ΔGоТ / RT,
или
Кр = exp(–ΔSо/R) exр(–ΔHо/RT) = Ko exp(–ΔHо/RT),
где Ko – постоянная, не зависящая от Т.
Это уравнение Вант-Гоффа, дающее критерий смещения равновесия с изменением условий (Т, Р, С).
Влияние Температуры
Из уравнения Вант-Гоффа видно, как изменяется Кр при изменении Т:
· для экзотермических реакций (ΔHо<0) Кр уменьшается с повышением Т (т.к. уменьшается показатель степени в формуле), следовательно, уменьшается и выход продуктов реакции. Равновесие смещается влево – в сторону продуктов;
· для эндотермической реакции (ΔНo>0) показатель степени растет, и Кр увеличивается с повышением Т.
Т.о., в обоих случаях концентрации соединений при нарушении равновесия меняются, как это и следует из принципа Ле Шателье.
Влияние давления
Повышение общего Р в системе будет сдвигать равновесие вправо, в сторону уменьшения Р. И наоборот, при понижении Р равновесие будет смещаться влево, в сторону реакции, повышающей Р.
Дата добавления: 2019-12-09; просмотров: 815;











