Лекция №5-8. Раздел 2 Химическая термодинамика
Первый закон термодинамики – это закон сохранения и превращения энергии. Закон является всеобщим и приложим к любым процессам, в том числе и к химическим реакциям и фазовым превращениям.
Q = U + A,
где Q – теплота,
U – изменение внутренней энергии
A – работа
Если реакция протекает при постоянных Т и Р, то
Qp = H,
где, H = U + PV – энтальпия системы
H – изменение энтальпии
H = U + PV
Если в результате реакций тепло выделяется, то тепловой эффект Н< 0 (реакция экзотермическая), при поглощении тепла Н> 0 (реакция эндотермическая).
U = Q – A
Работа – это передача энергии под действием силы, направленной от источника работы к ее приемнику, сопровождается изменением движения взаимодействующих тел.
A = F∙ l
где, l – расстояние, на которое перемещается тело.
При изотермическом сжатии газа работа равна:
A = RT∙ ln( 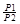 )
)
При изотермическом расширении газа:
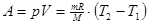
При изохорном процессе:
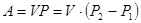
Теплота – это передача энергии под действием разности температур взаимодействующих тел.
Теплота положительна, если она сообщается окружающей средой систем, теплота отрицательна, если она сообщается системой окружающей среде.
Теплоемкость –теплота процесса в результате которого температура системы изменяется на 1К.
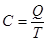

 [Дж/К]
[Дж/К]
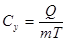 [Дж/кг∙К]
[Дж/кг∙К]
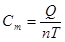 [Дж/моль∙К]
[Дж/моль∙К]
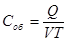 [Дж/м3∙К]
[Дж/м3∙К]
Зависимость между теплоемкостями:
Сm=Cy∙M ;
Соб=Су∙ρ ;
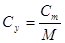 =
= 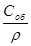 ;
;
C=mC=nCm=VCоб
Теплоемкость при P=const
C=∑Ci
Пример 1.
Давление азота, находящегося в сосуде объемом 3л, после нагревания возросло на Р=2,2МПа. Определить количество теплоты, сообщенной газу. Удельная теплоемкость азота при V=const, Cу=745Дж/кг∙К.
Решение.
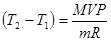 ;
;
Q= mCу∙(T2-T1); 
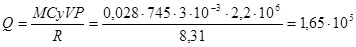 Дж
Дж
Пример 2.
Определить расход воды на закалку 200кг газа, если его температура понижается от 840˚С до 20˚С, а температура закалочной среды повышается от 20˚С до 100˚С. Теплоемкость воды равна 4,18 Дж/кг∙К, теплоемкость газа 3,5 КДж/кг∙К.
Решение.
Qприх=Cyгаза∙mгаза∙(Т2-Т1)
Qрасх=Сyводы∙mводы∙(Т2-Т1)
Сугаза∙mгаза∙(Т2-Т1)=Суводы∙mводы∙(Т2-Т1)


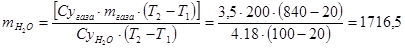 кг
кг
Термохимия
Основным законом термохимии является закон Гесса, согласно которому тепловой эффект реакции при постоянном давлении и объеме не зависит от пути реакции, а зависит лишь от конечного и начального состояния системы.
При стандартной температуре,
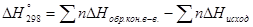 [КДж], n – количество вещества
[КДж], n – количество вещества
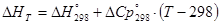 [КДж]
[КДж]
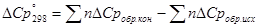 [Дж/К]
[Дж/К]
Второй закон термодинамики устанавливает возможность протекания реакции и предел их протекания.
При протекании процессов происходит изменение функции состояния системы, называемой энтропией или количественной мерой беспорядка в системе.
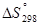 - энтропия
- энтропия
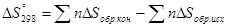 [Дж/моль∙К]
[Дж/моль∙К]
Энтропия для определения температуры:
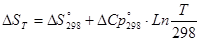 [Дж/К]
[Дж/К]
Т.к металлургические процессы чаще всего протекают при постоянном давлении, то их возможность определяют по изобарно-изотермическому потенциалу – энергии Гибба, обозначается – G.
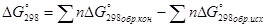 [КДж]
[КДж]
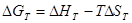 [КДж]
[КДж]
Таблица 1- Самопроизвольность протекания реакций
| ∆H | ∆S | ∆G | Свойство |
| − | + | ∆G<0 | Реакция протекает самопроизвольно при любых температурах |
| + | − | ∆G>0 | Реакция не протекает самопроизвольно ни при каких температурах; обратная реакция самопроизвольна |
| − | − | ∆G>0 ∆G<0 | (если >0) реакция протекает самопроизвольно, (если <0) реакция протекает самопроизвольно |
| + | + | ∆G>0 ∆G<0 | Реакция в любом случае самопроизвольна |
Важнейшая область применения 2-го закона термодинамики – анализ действия устройств для преобразования и передачи энергии: тепловых машин, холодильных установок, нагревателей, термообменников.
Основной характеристикой таких устройств является коэффициент полезного действия (КПД).
Тепловая машина – это устройство, способное постоянно трансформировать теплоту в работу.
Для постоянного производства работы тепловой машине необходимо иметь по крайне мери два источника теплоты с различными температурами.
Постоянное преобразование теплоты в работу возможно лишь при наличии не менее двух источников теплоты с различными температурами, которые позволили бы осуществить соответствующие тепловые потоки: Q1 – от нагревателя к тепловой машине и Q2 – от тепловой машины к холодильнику. Только при таком условии возможно действие тепловой машины.
Рабочим называется тело, используемое в тепловой машине для преобразования энергии и передачи ее от одних узлов машины к другим.
Рабочее тело (воздух) в тепловой машине при производстве ею работы совершает круговой процесс, состояние газа в цилиндре изменяется периодически, приобретая через равные промежутки исходное значение. При этом рабочее тело постоянно периодически принимает от нагревателя теплоту q1, совершает работу и сообщает оставшуюся часть полученной теплоты q2 холодильнику.
Теплота, полученная тепловой машиной от нагревателя, расходуется на теплоту, сообщенную машиной холодильнику, и работу, совершенною машиной
q1= q2+W или W=q1-q2
«Возникновение движущей силы в паровых машинах обязано не действительной трате теплорода, а его переходу от горячего тепла к холодильнику» и далее:
«… повсюду, где имеется разность температур, может происходить возникновение движущей силы»
Дата добавления: 2019-12-09; просмотров: 724;











