Влияние Концентрации
В соответствии с принципом Ле Шателье система тут же отзовется на такое воздействие: равновесие сместится так, чтобы скомпенсировать потерю данного вещества. Например, если из зоны реакции выводить вещество С или D (или оба сразу), равновесие будет смещаться вправо, а если выводит вещества А и В – влево.
Таблица 2 - Смещение равновесия при различных параметрах
| Параметр и его изменение | Направление смещения равновесия | |
| Концентрация | С исх > С конечн | С исх < С конечн |
| ↑ | → | ← |
| ↓ | ← | → |
| Давление | V исх > V конечн | V исх < V конечн |
| ↑ | → | ← |
| ↓ | ← | → |
| Температура | Эндо (–Q) | Экзо (+Q) |
| ↑ | → | ← |
| ↓ | ← | → |
Таблица 3 - Следствия первого закона термодинамики
| Следствие 1. | Изолированная система, нет обмена со средой, т.е.: W = 0; DU = 0. | Во всех процессах в замкнутой системе полная энергия системы сохраняется, меняется только форма. |
| Следствие 2. | Изотермический процесс, Т=const. Внутренняя энергия системы не меняется, DU=0, Q = W. | Вся теплота идет на совершение работы: W = nRT.2,3.lg(V2/V1); W = nRT.2,3.lg(P1/P2). |
| Следствие 3. | Изохорный процесс, V=const; DU¹0 Расширения нет, работа не совершается | Вся теплота идет на DU: Qv = n ∙CV (T2 – T1); QV = [(n ∙Cv∙T1) / T2 ] ∙ (P2–P1). |
| Следствие 4. | Изобарический процесс, Р=const; DU= Qр – W; Qр = DU + W = DH внутренняя энергия реагирующей системы определяется не только количеством высвобожденной или поглощенной теплоты, но и от того, сколько энергии система затрачивает или приобретает посредством произведенной работы. | Вся теплота идет на изменение энтальпии: Qр = n ∙Cр (T2 – T1); QP=[(n∙CP∙T1)/ V1](V2– V1). |
| Следствие 5. | Адиабатическая система. Q = 0; DU=Q – W; DU= – W; Cвязь P, V, T в начале и конце адиабатического процесса определяется уравнениями: P1V1γ = P2V2γ; T1V1 γ–1 = T2V2 γ–1; T1P1 1–γ = T2P21–γ. | Работа совершается за счет убыли внутренней энергии: |
| W=n∙CV ∙(T1–T2); W=(p1v1–p2v2)/g –1, W= n∙R∙(T1–T2) /g –1, | ||
| Для одноатомных газов CV=3/2R; CP=5/2R; g=CP/CV=1,67. | Для двухатомных газов (О2, Н2 …) CV=5/2R; CP=7/2R; g=CP/CV=1,40. |
n – количество вещества; CV, CP – молярная теплоемкость при изохорном и изобарическом процессах; Т1 и Т2 – начальная и конечная Т, P1 и P2 – начальное и конечное давление, V1 и V2 – начальный и конечный объем;
Лекция №9-11. Раздел 3 Кинетика химических реакций. Катализ
Химическая кинетика
Учение о скоростях химических реакций называется химической кинетикой.
Скорость химической реакции измеряется количеством вещества, вступающего в реакцию или образующегося в результате реакции в единицу времени в единице объема системы (для гомогенной реакции) или на единице площади поверхности раздела фаз (для гетерогенной реакции).
Скорость химической реакции есть число элементарных актов химической реакции, происходящих в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности (для гетерогенных реакций).
В случае гомогенного процесса, протекающего при постоянном объеме, скорость гомогенной химической реакции равно из изменению концентрации какого-либо из реагирующих веществ за единицу времени (моль/л). Это определение можно выразить уравнением:
U = 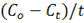 , где
, где
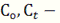 начальная концентрация вещества и концентрация вещества спустя время t.
начальная концентрация вещества и концентрация вещества спустя время t.
Дата добавления: 2019-12-09; просмотров: 812;











