Скорость реакции обычно характеризуют изменением концентрации какого-либо из исходных или конечных продуктов реакции в единицу времени.
О скорости реакции можно судить также по скорости изменения какого-либо свойства системы, например, окраски, электропроводности, давления, спектра и т. д.
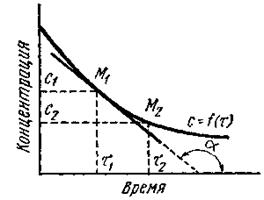
Если в моменты времени t1 и t2 концентрации одного из исходных веществ равны с1 и с2, то среднюю скорость v в интервале времени t1 и t2 можно выразить как
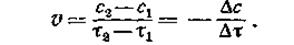
|
|
Поскольку речь идет об убыли концентрации исходного вещества, изменение концентрации в этом случае берется со знаком минус. Если скорость реакции оценивается увеличением концентрации одного из продуктов реакции, то производная берется со знаком плюс.
В ходе химических процессов концентрации веществ меняются непрерывно. Поэтому важно знать величину скорости реакции в данный момент времени, т. е. мгновенную скорость реакции. Последняя выражается первой производной концентрации по времени:
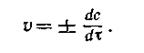 или
или 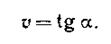
Скорость химических превращений зависит от природы реагирующих веществ, их концентраций и внешних условий.
Молекулярность реакции. В элементарном акте реакции могут принимать участие одна, две или три молекулы. По этому признаку различают одномолекулярные, двухмолекулярные и трехмолекулярные реакции.
Примером двухмолекулярной реакции является
Н2 + J2 = 2НJ
трехмолекулярной
2NО (г) + С12 (г) = 2NОС1 (г)
Вероятность одновременного соударения большего числа частиц очень мала, поэтому даже трехмолекулярные реакции весьма редки, а четырехмолекулярные неизвестны. В соответствии со сказанным в большинстве случаев стехиометрическое уравнение не определяет характера протекания реакции, т. е. ее механизма. Большинство реакций состоит из ряда более простых элементарных стадий, которые сами протекают по одно-, двух- или трехмолекулярному механизму.
Даже реакции с относительно простым стехиометрическим уравнением часто оказываются более сложными, чем это можно было бы заключить по уравнению реакции. Например, реакция
Н2 (г) + С12(г)=2НС1 (г)
в противоположность реакции взаимодействия Н2 и J2 в действительности протекает очень сложно и к двухмолекулярным не относится.
Закон действующих масс. Скорость гомогенных реакций зависит от числа встреч реагирующих частиц в единицу времени в единице объема. Вероятность одновременного соударения взаимодействующих частиц в свою очередь пропорциональна произведению концентраций реагирующих веществ.
Таким образом, скорость реакции пропорциональна произведению концентраций реагирующих веществ.
Указанная закономерность называется законом действующих масс (Гульдберг и Вааге).
Для двухмолекулярной реакции взаимодействия водорода и иода
Н2(г) +J2(г) = 2НJ(г)
закон действующих масс выражается в виде следующего кинетического уравнения:
v = k×CH2×CJ2
где v — скорость реакции;
CH2×CJ2— концентрации соответственно Н2 и J2.
Кинетическое уравнение для трехмолекулярной реакции
2NO(г) + С12 (г) = 2NОС1 (г) будет
v = k×CNO2×CJ2
Коэффициент пропорциональности k называется константой скорости реакции. Величина k численно равна скорости реакции, когда концентрации реагирующих веществ равны единице. Константа скоростй реакции зависит от природы реагирующих веществ и от температуры.
Энергия активации. Для того чтобы совершился элементарный акт химического взаимодействия, реагирующие частицы должны столкнуться друг с другом. Однако далеко не каждое столкновение частиц приводит к их химическому взаимодействию. Последнее происходит в том случае, когда частицы приближаются на расстояние, при котором становится возможным перераспределение электронной плотности и возникновение новых химических связей. Следовательно, сталкивающиеся частицы должны обладать энергией, достаточной для преодоления сил отталкивания (энергетического барьера), возникающих между их электронными оболочками. Такие реакционноспособные частицы называют активными, а энергия, необходимая для преодоления энергетического барьера,— энергией активации реакции.
Группировку частиц, находящихся в процессе взаимодействия (т. е. перераспределения связей), называют активным комплексом.
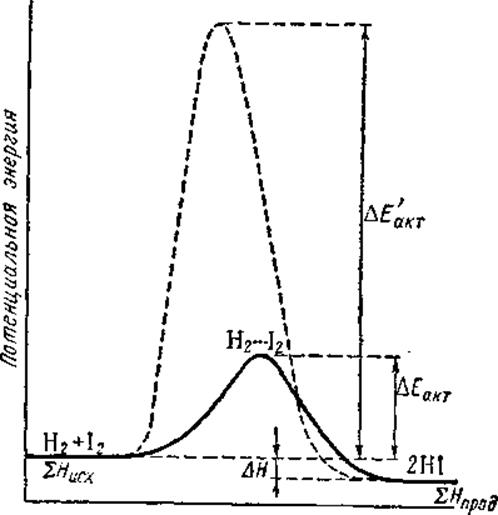
Таким образом, при химическом превращении переход системы из энергетического состояния SНисх в состояние SНпрод осуществляется через некоторый энергетический барьер Еакт. Разность первоначального и конечного уровней энергии системы составляет тепловой эффект реакции DН. Так, на рисунке изображена энергетическая схема хода реакции
Н2(г) +J2(г) = 2НJ(г)
|
| Рисунок. Энергетическая схема хода реакции Н2(г) +J2(г) = 2НJ(г) (при 600-800°К) |
По оси ординат отложена потенциальная энергия системы. В качестве абсциссы использована так называемая координата реакции (реакционный путь), которая в первом приближении характеризует изменения в межъядерных расстояниях взаимодействующих частиц.
Рассматриваемая реакция протекает следующим образом. Активные молекулы Н2 и J2 при столкновении объединяются в промежуточный активный комплекс Н2...J2. В этом комплексе связи Н—J начинают образовываться одновременно с разрывом связей Н-Н и J-J:
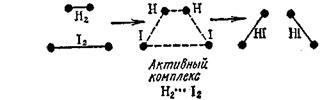
|
В результате энергия активации (168 кдж) оказывается меньше, чем энергия, необходимая для полного разрыва связей в исходных молекулах (571 кдж).
Иными словами, путь реакции через образование активного комплекса энергетически более выгоден, чем путь через полный разрыв связей вступающих в реакцию молекул. Поэтому-то подавляющее большинство реакций и проходит через образование промежуточных активных комплексов.
Таким образом, энергия активации — это энергия, необходимая для превращения реагирующих веществ в состояние активного комплекса.
Для эндотермического процесса распада
2НJ (г) = Н2 (г) + J2 (г), DH=17 кдж
реакционный путь будет обратным пути экзотермической реакции синтеза HJ.
Как видно из рисунка, в этом случае начальному состоянию системы соответствует уровень энергии SDH прод, конечному SНисх, а энергия активации реакции составляет .Еакт+DH (185 кдж).
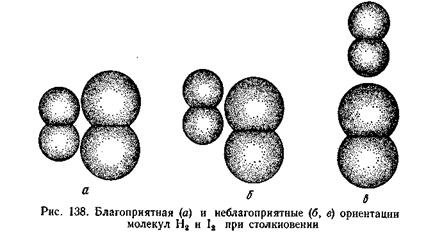
Энтропия активации. Кроме энергии активации важным условием осуществления химической реакции является ориентация молекул в момент столкновения. Перераспределению электронной плотности в активном комплексе более всего благоприятствует условие, когда молекулы ориентированы как показано на рисунке (а). При ориентации (б) гораздо меньше вероятность протекания реакции.
|
Для рассматриваемой реакции вероятность пространственно благоприятных столкновений активных молекул составляет 0,1 от общего числа столкновений. Поэтому реакция между молекулами водорода и иода протекает сравнительно медленно, хотя для ее осуществления требуется небольшая энергия активации.
Таким образом, для осуществления реакции молекулы при столкновении должны быть определенным образом ориентированы и обладать достаточной энергией.
Вероятность надлежащей ориентации при столкновении характеризуют с помощью энтропии активации DSакт. Последняя пропорциональна отношению числа благоприятных способов ориентации к общему числу способов ориентации:

|
Очевидно, чем жестче требования ориентации, тем меньше (более отрицательной) делается величина DSакт.
Влияние температуры. Зависимость скорости реакции от температуры, энергии активации и энтропии активации определяется следующим выражением для константы скорости реакции:
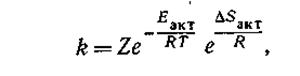
|
где Z — в первом приближении общее число столкновений между молекулами в секунду*; Т — абсолютная температура; R — газовая постоянная; е — основание натуральных логарифмов.
Вероятность того, что столкнувшиеся молекулы будут иметь достаточную энергию взаимодействия пропорциональна величиене:
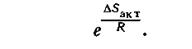
|
Из уравнения для К видно, что, поскольку Т входит в показатель степени, скорость химической реакции очень чувствительна к изменению температуры. Например, при повышении температуры на 100° скорость реакции
Н2 (г) + J2 (г) = 2НJ(г)
возрастает примерно в 1000 раз.
Опытные данные свидетельствуют о справедливости правила Вант-Гоффа: при повышении температуры на каждые 10° скорость реакции увеличивается примерно в 2—4 раза. Из уравнения для К также следует, что чем больше энергия активации, тем значительнее влияние температуры на скорость реакции.
Дата добавления: 2021-11-16; просмотров: 516;











