Потенциалы окислительно-восстановительных (редокси-)
Электродов
Любая электродная реакция представляет собой окислительно-восстановительную реакцию. Однако к окислительно-восстановительным (редокси-) электродам относят только те электроды, в реакциях которых не принимают непосредственного участия металлы и газы. Такие электроды состоят из металлического проводника, контактирующего с раствором, содержащим окислители и восстановители. К металлу в редокси-электродах предъявляются те же требования, что и к металлическому проводнику в газовых электродах.
В качестве примера окислительно-восстановительного электрода можно привести систему
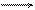
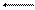 Fe3+ + e Fe2+.
Fe3+ + e Fe2+.
В общем виде равновесие на электроде для простых систем можно представить как
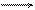
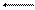 ОХ + ne Red.
ОХ + ne Red.
Схема электрода соответственно записывается как
Pt/ОX, Red,
где ОХ – окисленная форма вещества;
Red – восстановленная форма вещества.
Уравнение Нернста для расчета потенциала редокси-электрода имеет вид
ЕОх/Red + Е°Ох/Red + 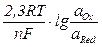 . (4.7)
. (4.7)
В более сложных редокси-процессах участвуют ионы ОН- или Н+.
Рекдокси-потенциал относительно мало зависит от активностей ионов и существенно меняется с изменением pHраствора. Для определения направления окислительно-восстановительных процессов необходимо рассчитать ЭДС как разность потенциалов редокси-электродов, участвующих в данном процессе. Реакция будет протекать в направлении, в котором ЭДС положительна.
Дата добавления: 2021-11-16; просмотров: 421;











