Кинетика электродных процессов. Поляризация
Равновесные потенциалы электродов могут быть определены в условиях отсутствия в цепи тока. При прохождении электрического тока потенциалы электродов изменяются. Изменение потенциалов электрода при прохождении тока называется поляризацией:
DЕ = Еi –Ep,
где DЕ – поляризация;
Еi – потенциал электрода при прохождении тока;
Ep – равновесный потенциал.
Термин «поляризация» употребляется не только для обозначения величины изменения потенциала, но и самого явления изменения потенциала при прохождении тока. Так как поляризация может наблюдаться как на катоде, так и на аноде, то различают катодную и анодную поляризацию - DЕк и DЕa.
Изменение потенциала при прохождении тока также называется перенапряжением. Этот термин обычно употребляют, когда известна причина изменения потенциала. Его также относят к некоторым конкретным процессам, например к катодному выделению водорода (водородное перенапряжение).
Для экспериментального определения поляризации строят кривую зависимости потенциала электрода от протекающего через электрод тока. Из закона Фарадея следует, что ток пропорционален количеству вещества, прореагировавшего на электроде в единицу времени, т.е. скорости электро-химической реакции. Поэтому значение тока может быть использовано для количественной оценки скорости электрохимической реакции. Так как электроды могут быть разными по площади, то в зависимости от площади электрода при одном и том же потенциале могут быть разные токи, поэтому скорость реакции относят к единице площади поверхности. Отношение тока к площади электрода называют плотностью тока i = I/S.
Графическую зависимость потенциала от плотности тока называют поляризационной кривой (рис. 4.5).
Рис. 4.5. Поляризационные кривые
двух электродов
Величину поляризации электрода можно определить по разности между потенциалом при прохождении тока Ei и равновесным потенциалом Ep. Из кривых поляризации видно, что для получения большего тока необходимо большее отклонение потенциала от равновесного значения. Таким образом, скорость электрохимической реакции может быть увеличена повышением поляризации, соответственно поляризация одного и того же электрода тем выше, чем больше плотность тока.
Скорость и механизм протекания электрохимических реакций изучает электрохимическая кинетика. Особенностью электрохимических реакций является влияние потенциала на их скорость. Любая электрохимическая реакция протекает как минимум в три стадии: подвод реагентов к электроду, собственно электрохимическая реакция (может включать и химические реакции), отвод продуктов реакции от электрода. Если бы все эти стадии протекали мгновенно, то потенциал электрода при прохождении тока не изменялся бы и соответственно поляризация была бы равна нулю. Однако все три стадии протекают с конечными скоростями, причем одна из них лимитирует всю реакцию, и для ее ускорения необходимо изменение потен-циала электрода, т.е. поляризация. Следовательно, возникновение поляризации обусловлено замедленностью отдельных стадий электрохимического процесса. Соответственно в зависимости от характера замедленной стадии на электроде возникает концентрационная или электрохимическая поляризация.
Изменение потенциала электрода вследствие изменения концентрации реагентов в приэлектродном слое при прохождении тока называется концентрационной поляризацией. В свою очередь изменение концентрации реагирующих веществ в приэлектродном слое вызывается замедленностью подвода реагентов к электроду или отвода продуктов реакции от электрода. Так как по уравнению Нернста потенциал электрода пропорционален логарифму активности ионов (в разбавленных растворах – концентрации ионов), то концентрационная поляризация должна быть пропорциональна разности логарифмов активностей (концентраций) ионов в приэлектродном слое аS и в объеме раствора аV:
DЕконц = 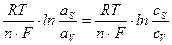 . (4.8)
. (4.8)
С увеличением плотности тока растет разность между активностями (концентрациями) в приэлектродном слое и в объеме раствора и соответственно возрастает концентрационная поляризация:
DЕконц = 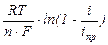 , iпр = n×F×сV×D/d, (4.9)
, iпр = n×F×сV×D/d, (4.9)
где iпр – предельная плотность тока;
cV – концентрация реагента в объеме раствора;
D – коэффициент диффузии реагента;
d - толщина диффузного слоя.
Как видно из уравнений (4.8) и (4.9), концентрационная поляризация снижается с увеличением коэффициента диффузии и концентрации реагента и уменьшением толщины диффузионного слоя. Диффузионным слоем называется тонкий слой около поверхности электрода, в котором происходит перемешивание жидкости (отсутствие конвекции) и соответственно молекулы переносятся лишь путем диффузии. Толщина этого слоя, а также концентрационная поляризация уменьшаются при перемешивании жидкости (раствора). На рис. 4.6 приведены типичные кривые зависимости «потенциал-плотность тока» для концентрационной поляризации.
Изменение потенциала, обусловленное замедленностью собственно электрохимических стадий реакций, называется электрохимической поляризацией (перенапряжением). Замедленность электрохими-ческих стадий объясняется существенной перестройкой структуры реагирующих частиц в ходе реакции. Как и при химической реакции, электрохимические процессы происходят лишь тогда, когда реагирующие частицы обладают энергией, которая больше или равна энергии активации.
Рис. 4.6. Кривые «потенциал-плотность тока»
при концентрационной поляризации с
перемешиванием (1) и без перемешивания (2)
Скорость электрохимических реакций, как и химических, может быть увеличена повышением температуры и применением катализатора. Энергия активации может быть снижена при изменении потенциала электрода по сравнению с его равновесным потенциалом, т.е. при поляризации. Так как при уменьшении энергии активации растет скорость реакции, то увеличение поляризации приводит к ускорению электрохимической реакции и к повышению плотности тока. Связь между электрохимическим перенапряжением DЕЭЛ и плотностью тока выражается уравнением Тафеля
DЕЭЛ = а +в×lgi.
Константа в зависит от природы реакции и от температуры и при 298 К лежит в пределах 0,03…0,15. Константа а зависит от природы реакции, материала электрода, состава раствора и температуры.
Электрохимическая поляризация уменьшается с уменьшением температуры и концентрации реагента и не зависит от перемешивания раствора.
5. ВИДЫ коррозии
Дата добавления: 2021-11-16; просмотров: 523;











