Электролиз растворов и расплавов
Явление выделения вещества на электродах при прохождении через электролит тока, а также процессы окисления или восстановления на электродах, сопровождающиеся приобретением или потерей частицами вещества электронов, называются электролизом.
В промышленности электролиз применяется в основном для анодного растворения металла и его катодного осаждения из растворов и расплавов.
Вещества, у которых нормальный потенциал больше -1 по отношению к потенциалу нормального водородного электрода, получают путем электролиза растворов (медь, цинк). Металлы с нормальным потенциалом меньше -1 получить таким способом не удается. Поэтому при их производстве применяют электролиз расплавов солей этих металлов (литий, калий, алюминий, магний).
Если в электролизной ванне процесс происходит с поглощением электрической энергии, ванна называется электролизером.
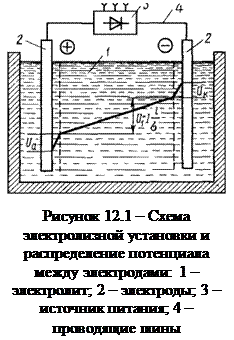 Принципиальная схема электролизера показана на рис. 12.1.
Принципиальная схема электролизера показана на рис. 12.1.
На аноде переход металла из металлического состояния (Ме0) в ионное происходит в результате отдачи металлом электронов Ме0 - пе → Меп+ (анодное растворение), где п - число единичных зарядов. На катоде ион приобретает электроны и переходит в металлическое состояние Меп+ + пе → Ме0 (катодное осаждение).
Напряжение на электролизной ванне можно представить состоящим из трех составляющих: напряжение электрохимического разложения вещества, приэлектродные падения потенциала и падение напряжения в электролите:
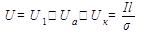 , (12.3)
, (12.3)
где U1 - напряжение электрохимического разложения вещества; Ua, Uк - анодное и катодное падения потенциала соответственно; I - сила тока в ванне; l - расстояние между электродами; σ - проводимость электролита.
Мощность, выделяющаяся в электролизной ванне,
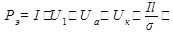 , (12.4)
, (12.4)
Только часть этой мощности (IU1)идет на электрохимическое разложение вещества, остальная же мощность расходуется на нагрев электролита и транспортировку ионов через раствор.
Характерной величиной, определяющей интенсивность электролиза, является электродная плотность тока (А/м2):
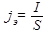 , (12.5)
, (12.5)
где I - сила тока; S - поверхность погруженной в электролит части электрода.
При проведении промышленных процессов электролиза не удается достичь теоретических значений выделения веществ на электродах. Такое явление обусловлено следующими основными причинами: перезарядкой ионов; наличием в электролитах ионов разной валентности; взаимным разрядом ионов; взаимодействием продуктов электродных реакций между собой или с электролитом, а также катодным восстановлением продуктов.
Электролиз меди.Целью электролиза меди является снижение содержания примесей в черновой меди, полученной плавкой в отражательных печах, извлечение находящихся в ней благородных и других ценных металлов и получение чистой электролитической меди.
Процесс ведут в электролизных ваннах ящичного типа. В ванне устанавливаются литые аноды черновой меди, между которыми подвешиваются тонкие пластины чистой меди (катоды). После этого в ванну подают электролит, который представляет собой водный раствор медного купороса, подкисленный серной кислотой для уменьшения сопротивления.
Отлитые из черновой меди аноды представляют собой плиты прямоугольной формы толщиной 35 - 45 мм и массой около 300 кг. Катоды изготовляют из листовой электролитической меди толщиной 0,6 - 0,7 мм. Для надевания на штанги при подвешивании в ванны к катодам приваривают ушки, расстояние между поверхностями соседних анодов и катодов составляет 35 - 40 мм.
При пропускании через ванну постоянного электрического тока происходит растворение черновой меди анодов и осаждение чистой меди на катодах. Благородные металлы и некоторые примеси в виде шлама выпадают в осадок, некоторые другие примеси (никель) переходят в раствор.
Электролиз цинка.Высококачественный цинк получают путем электролиза водных растворов его солей. В ваннах устанавливаются алюминиевые катоды и свинцовые аноды. Затем они заполняются водным раствором сернокислого цинка ZnSO4 (5 - 6%), который диссоциирует на катионы цинка Zn2+ и анионы SO42-и серной кислоты H2SO4, диссоциирующей на катионы водорода Н+ и анионы SO42-.
Во время электролиза на катоде осаждается металлический цинк, на аноде выделяется газообразный кислород, а в растворе образуется серная кислота H2SO4.
В электролизных цехах применяют ванны из сборного железобетона (иногда стальные) с защитой из кислотоупорных материалов. Обортовку ванн и сливные короба выполняют из винипласта. Снаружи ванны покрывают кислотоупорной краской, битумом или резиной. В дне ванн имеется отверстие для выпуска шлама.
Аноды изготовляют из пластин свинца 5-8 мм, с добавкой 1% серебра для снижения коррозии. Катоды изготовляют из листового алюминия толщиной 4 мм.
Электролиз алюминия.При нормальном потенциале выделения металла меньше - 1 В осадить его на катоде методом электролиза раствора невозможно, так как на катоде будут выделяться в основном водород и содержащиеся в электролите и аноде примеси. Так как нормальный потенциал алюминия - 1,67 В, то его получают путем электролиза расплавленных солей. В этом случае электролитом является раствор оксида алюминия Аl2О3 в расплавленном криолите (Na3AlF6).
Поскольку фторидные расплавы являются сильно агрессивными средами, электролиз алюминия ведут с расходуемым угольным электродом, а внутренние поверхности ванн футеруют угольными плитами и блоками.
Электролизеры для получения алюминия можно классифицировать по ряду признаков:
1. По мощности (силе тока): 40-50 кА - малой мощности; 60-80 кА - средней мощности; 100-160 кА - большой мощности и 200-250 кА - сверхбольшой.
2. По способу подвода тока: боковой - электролизеры малой и средней мощности; верхний - электролизеры большой мощности.
3. По конструкции анода: самоспекающийся за счет теплоты ванны и обожженный. Обожженные аноды имеют только верхний подвод тока. Самоспекающиеся аноды устанавливают по одному на каждой ванне.
Ванны имеют прямоугольную форму. Корпус электролизера сварен из стальных листов, может быть с днищем и без днища. Корпус ванны снизу частично заполнен шамотной кладкой для теплоизоляции.
Электролиз идет при температуре 900 градусов Цельсия, алюминий собирается на днище ванны в расплавленном виде, откуда он периодически откачивается.
Дата добавления: 2018-05-10; просмотров: 1483;











