Силы, действующие между частицами твердого тела
До сих пор мы не учитывали природу сил, удерживающих частицы в строго упорядоченном положении. На самом деле необходимо учитывать природу этих сил, так как она определяет энергию связи в решетке и основные ее свойства. Рассмотрим силы взаимодействия и соответственно энергию связи для 2-х частичной модели (см. рисунок 4.1).
 |
Пусть мы имеем две частицы одна, из которых расположена в начале координат, а вторая расположена в бесконечности и из бесконечности приближается к первой частице.
Сила притяжения обычно описывается следующей формулой:
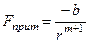 ,
,
где b и m - постоянные целые числа и зависят от природы решетки.
По мере сближения частиц при малых r резко возрастает сила отталкивания.
Обычно полагают
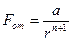 ,
,
где a и n целые постоянные числа, зависящие от типа решетки.
Для того чтобы силы отталкивания при малых расстояниях между частицами превышали силу притяжения, необходимо чтобы n>m (для некоторых кристаллов полагают n=12, m=6).
Тогда суммарную силу взаимодействия можно представить в виде:
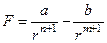 .
.
Зная, что
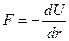 ,
,
можно показать, что суммарная потенциальная энергия взаимодействия системы 2-х частиц U определяется формулой:
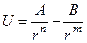 ,
,
где 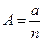 ,
, 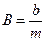 .
.
Ионные кристаллы
В узлах кристаллической решетки ионных кристаллов находятся положительные катионы и отрицательные анионы. Силы взаимодействия между ними по своей природе являются электростатическими. Для того чтобы система была устойчивой, необходимо чтобы ближайшими соседями ионов одного знака были ионы противоположного знака. При разъединении кристалла на отдельные частицы мы получим систему разноименно заряженных ионов, не взаимодействующих между собой.
Типичным представителем ионных кристаллов является NaCl, структура которого представлена на рисунке 4.2. Из рисунка 4.2, где черные кружки обозначают Na+, а белые - Сl-, видно, что центральный ион хлора имеет шесть ближайших соседей - ионов натрия.
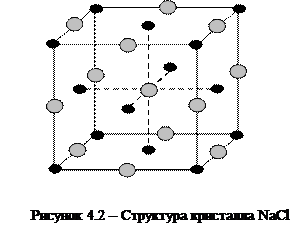 |
Кристаллическая структура хлористого натрия может быть представлена как совокупность двух кубических гранецентрированных решеток Браве, из ионов натрия и хлора и смещенных друг относительно друга на половину ребра куба.
Число ионов противоположного знака, которое составляет ближайшее окружение данного иона в кристалле, называется координационным числом. Значение координационного числа определяется величиной отношения радиусов ионов противоположного знака:
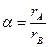 .
.
Чем ближе это отношение к единице, тем больше координационное число, что подтверждается данными, приведенными в таблице 4.1.
Радиус аниона превосходит радиус катиона. Следовательно, кристаллическую решетку условно можно представить себе как систему плотно упакованных анионов, в пустотах между которыми расположены катионы. В зависимости от соотношения ионных радиусов изменяется координационное число, а значит и тип решетки.
Таблица 4.1 - Зависимость координационного числа от радиусов ионов противоположного знака
| Координационное число | |||||
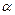
| 1>a>0.73 | 0.73>a a>0.41 | 0.41>a a>0.22 | 0.22>a |
Примеры:
1. 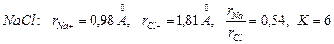 .
.
2. 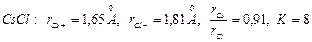 .
.
В зависимости от внешних условий радиусы катионов и анионов меняются по-разному. Вследствие этого отношение ионных радиусов может меняться в широких пределах, а это приводит к изменению типа решетки.
Иллюстрацией определяющего значения соотношения ионных радиусов в «выборе» типа решетки ионного кристалла служит тот факт, что если под влиянием внешних воздействий (температура, давление) это соотношение существенно изменится, то изменится и кристаллическая структура данного ионного соединения.
Способность одного и того же вещества кристаллизоваться в различных кристаллических структурах называется полиморфизмом. Явление полиморфизма очень широко распространено. В сравнительно небольшом интервале температур и давлений более половины химических элементов проявляют полиморфизм. Исследования кристаллической структуры элементов при высоких давлениях привели к обнаружению ранее неизвестных полиморфных превращений. Круг полиморфных веществ расширился настолько, что стало возможным высказать предположение, что в природе вообще не существует элементов, сохраняющих одну и ту же структуру в достаточно широком интервале температур и давлений. Несколько примеров полиморфизма ионных кристаллов приведено ниже.
С повышением температуры радиус аниона увеличивается быстрее, чем радиус катиона, вследствие чего происходит увеличение разности размеров ионных радиусов. Поэтому некоторые кристаллы (например, хлористый цезий и хлористый рубидий) при повышении температуры изменяют свою кристаллическую структуру: из объемноцентрированной перестраиваются в примитивную кубическую решетку.
Обратная перестройка наблюдается при увеличении давления, когда радиус аниона уменьшается быстрее, чем радиус катиона. При этом происходит сближение размеров ионных радиусов, которое может привести к переходу кристалла из примитивной кубической решетки в объемноцентрированную. Такого рода перестройка кристаллической структуры при повышении давления наблюдается у хлористого, бромистого и йодистого калия, бромистого и йодистого рубидия.
Из описания ионных кристаллов можно сделать вывод, что внутри них нельзя обнаружить такие группировки частиц, которые соответствовали бы молекулам. Поясним этот вывод следующими рассуждениями.
В кристалле поваренной соли каждый ион хлора окружен шестью ионами натрия и наоборот. Все шесть ближайших соседей какого-либо иона, являющихся ионами противоположного знака, одинаково удалены от рассматриваемого иона, поэтому в таком кристалле не представляется возможным выделить какую-либо пару ионов, более тесно связанных друг с другом, чем с другими соседями. Следовательно, в кристалле хлористого натрия не существует изолированной пары ионов, которую можно отождествить с молекулой NaCl. Правильнее считать весь монокристалл ионного соединения одной гигантской молекулой, в которой каждый ион испытывает значительное взаимодействие со стороны всех остальных ионов.
При растворении в воде такой кристалл распадается на ионы, а при испарении - на молекулы. Можно сказать, что плавление ионных кристаллов также приводит к образованию ионов, так как расплавы ионных солей обладают хорошей электропроводностью, а это говорит о достаточно высокой степени диссоциации жидкости.
Ионные кристаллы обладают малой электропроводностью при низких температурах, хорошей ионной проводимостью при высоких температурах и сильным инфракрасным поглощением.
В ионных кристаллах одинаковой структуры силы взаимодействия между положительными и отрицательными ионами тем больше, чем больше их валентность и чем меньше сумма их радиусов. А чем больше сила взаимодействия между ионами, тем выше температура плавления кристалла и тем меньше его растворимость.
Атомные кристаллы
В узлах кристаллической решетки атомных кристаллов распложены нейтральные атомы. Силы взаимодействия между атомами в таких кристаллах называются обменными. Рассмотрим природу этих сил на примере молекулы водорода H2. Система из двух атомов водорода схематически изображена на рисунке 4.3. Протоны на схеме обозначены буквами а и b, a электроны - цифрами 1 и 2. Расстояния между элементами схемы обозначены буквой r.
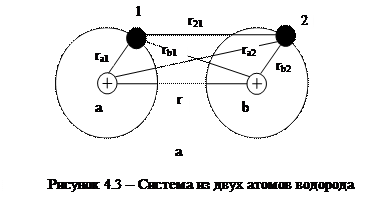 |
Плотность электронного облака, описывающего состояние электрона в атоме водорода, очень быстро падает с увеличением расстояния, поэтому при больших расстояниях между протонами атомы можно рассматривать как изолированные, а энергию системы, состоящей из двух удаленных атомов, можно считать равной 2Е0, где Е0 - энергия изолированного атома в невозбужденном состоянии.
По мере уменьшения расстояния r увеличивается степень перекрытия электронных облаков, т. е. увеличивается вероятность перехода электрона к «чужому» протону. Расчет показывает, что при r»50  электрон сможет побывать у «чужого» протона примерно один раз за 1012 лет. Сблизим атомы на расстояние r»2
электрон сможет побывать у «чужого» протона примерно один раз за 1012 лет. Сблизим атомы на расстояние r»2  . В этом случае электрон первого атома, может перейти ко второму, 1014 раз в секунду. Поэтому теряет смысл говорить о принадлежности данного электрона к данному атому. Фактически образуется общая пара электронов для двух атомов.
. В этом случае электрон первого атома, может перейти ко второму, 1014 раз в секунду. Поэтому теряет смысл говорить о принадлежности данного электрона к данному атому. Фактически образуется общая пара электронов для двух атомов.
Обобществление электронов приводит к перераспределению электронной плотности в пространстве между ядрами атомов и вне ядер. Плотность электронного облака в пространстве между ядрами становится больше плотности, которая бы получилась при простом сложении отдельных плотностей. При этом в пространстве вне ядер оказывается, что суммарная плотность электронного облака будет меньше той, которая бы получилась при сложении плотностей электронных облаков отдельных атомов.
Появление состояния с повышенной плотностью электронного облака в межъядерном пространстве вызывает уменьшение энергии системы и приводит к возникновению сил притяжения между ядрами. В основе возникновения такой связи лежит обменное взаимодействие или обменный эффект, обусловленный обменом атомов электронами и имеющий чисто квантовую природу. Силы такого взаимодействия называются обменными силами, а их энергия - обменной энергией.
Обменное взаимодействие возникает и между другими тождественными частицами, например, между протонами или между нейтронами, когда они сближаются до расстояний, обеспечивающих существенное перекрытие волновых функций этих частиц, что имеет место в атомном ядре.
Нужно отметить, что в зависимости от ориентации спинов обобществленных электронов обменное взаимодействие может проявляться не только в возникновении сил притяжения, но и в возникновении сил отталкивания между сближающимися атомами.
Возникающая в результате обменного взаимодействия ковалентная связь образуется в том направлении, в котором расположена наибольшая часть электронного облака коллективизированных электронов. Это означает, что такая связь имеет направленный характер.
Вследствие того, что ковалентная связь возникает посредством взаимодействия валентных электронов, кристаллы, в которых атомы связаны такой связью, иногда называют валентными.
Представление о перекрывании электронных облаков соседних атомов и обменном направленном взаимодействии двух электронов с антипараллельными спинами составляют основу современной теории строения молекул. Эти представления дали простое объяснение загадочной способности химических сил к насыщению.
Действительно, к молекуле водорода не может присоединиться еще один атом водорода, так как спин его электрона будет параллелен спину одного из электронов, входящих в молекулу водорода, и между ними возникнут силы отталкивания, препятствующие присоединению третьего атома.
В атомных кристаллах тоже нельзя выделить отдельных группировок частиц, которые можно было бы назвать молекулами. Весь кристалл можно рассматривать как гигантскую молекулу с ковалентной связью. Однако при разрушении ковалентной связи, в отличии от ионной, никогда не возникает ионов.
Ковалентная химическая связь очень прочна, поэтому атомные кристаллы отличаются высокой температурой плавления, большой твердостью и малой летучестью.
Дата добавления: 2021-11-16; просмотров: 719;











