Действие радиации на организм человека (В.В. Маркина, 2006)
| Форма облучения, доза | Немедленные реакции организма | Отдаленные последствия |
| I. Острое облучение Очень большие дозы 1-10 кЗв Большие дозы 4-6 Зв Средние дозы 2-4 Зв Небольшие дозы 1 Зв | Смерть от поражения ЦНС Смерть Тяжелая лучевая болезнь (50% смерть) Лучевая болезнь средней тяжести Легкое недомогание | Сокращение сроков жизни, снижение иммунитета, роста, поражение ЦНС. Радиационный канцерогенез (лейкемия, рак легких, молочной железы). Бесплодие. Наследственные пороки развития, эмбриональная гибель, наследственные болезни |
| II. Хроническое облучение Доза накапливается. Действие зависит от дозы и промежутков между облучениями | Смерть от тяжелой лучевой болезни Лучевая болезнь. |
Вместе с тем чувствительность к ионизирующему излучению (радиочувствительность) различна у разных видов живых организмов, организмов одного и того же вида, разных тканей и органов одного организма. Особенно чувствительны к действию ионизирующего излучения ткани с высокой степенью пролиферации: костный мозг, эпителий кишечника, клетки половых желез (рисунок 13).
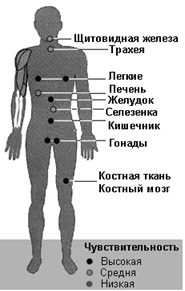
Рис. 13. Чувствительность организма человека к ионизирующему излучению
Большую роль в развитии прямых и опосредованных эффектов облучения играют низкомолекулярные продукты различной химической природы, объединяемые под общим названием «радиотоксины». Действие радиотоксинов проявляется в следующем: в малых дозах они усиливают синтез ДНК, воздействуя на мембраны, активируя цАМФ, взаимодействуя с белками-репрессорами; в больших дозах тормозят синтез ДНК, угнетают деление клетки, вызывают хромосомные аберрации, генные мутации, пикноз (сморщивание) ядер, понижают устойчивость биологических мембран, активность мембранно-связанных ферментов.
Характер действия радиотоксинов на живые клетки имитирует действие самого ионизирующего излучения, т.е. они обладают широким действием и принимают активное участие во вторичном поражении генома и мембран клеток.
Малые дозы ионизирующего излучения вызывают радиобиологические эффекты, противоположные характеру воздействия больших доз:
ü стимулируют рост, развитие, плодовитость, неспецифический иммунитет, общую сопротивляемость организма;
ü их воздействие осуществляется через регуляторные механизмы генетических и мембранных структур;
ü играют важную роль пусковых механизмов, при этом эффект мало зависит от количества поглощенной энергии и увеличивается при облучении дробными дозами (аккумуляция).
Кроме того, следует подчеркнуть беспороговость действия малых доз ионизирующего излучения на разные системы организма, способность к накоплению дозы и как следствие проявление в виде отдаленных эффектов: вегетососудистой дистонии, увеличение щитовидной железы, изменение иммунного статуса, сочетанные поражения сердца, легких, мозга, желудочно-кишечного тракта, увеличение вероятности возникновения опухолей, мертворождений, выкидышей (В. Т. Найда и др. 1994; Т.И. Траверсе, 1994; Г. В. Римарчук, 1994). Исследование состояния здоровья людей, проживающих в местностях, получивших умеренные радиоактивные загрязнения после чернобыльского взрыва, или отселенных из зон интенсивного загрязнения, показывает, что основной причиной таких болезней является срыв адаптационных механизмов. Поэтому наибольшее распространение получают так называемые стресс-зависимые болезни. Характерными являются также иммунодефициты, в связи с чем и большая подверженность инфекциям, острым респираторным заболеваниям (Г.В. Архангельская, 1993). Вместе с тем многие исследователи отмечают рост числа опухолевых заболеваний кроветворных органов и щитовидной железы (В.Г. Найда, 1994; С.В. Петренко, 1990), изменение показателей периферической крови (Л.Н. Acтахова, 1991; Т.Н. Лазюк и др., 1990).
При сочетании ионизирующего излучения с другими экологическими факторами возможны разные реакции комбинирований действия:
ü аддитивность (суммирование эффектов от каждого из факторов независимо от последовательности действия);
ü синергизм (результат совместного действия превосходит эффект, ожидаемый от суммированного воздействия);
ü сенсибилизация (потенцирование, усиление эффектов факторами, которые сами по себе эффекта не вызывают).
Эти виды сочетанного действия должны учитываться при анализе тяжести радиобиологического эффекта. К числу факторов, усиливающих радиационное поражение, относятся:
ü повышение температуры окружающей среды;
ü высокое содержание кислорода в тканях, усиливающее первичное поражение, но облегчающее пострадиационное восстановление;
ü воздействие ультразвука, мутагенов, ядов, канцерогенных факторов.
Описанное явление находит применение в медицине при лечебном совместном использовании ионизирующего излучения и цитостатиков (препаратов, вызывающих апоптоз злокачественных клеток), излучения и гипертермии для лечения опухолей, при использовании любых средств, снижающих содержание в тканях кислорода (адреналина, нитрита натрия, морфина, цианидов), для ослабления поражающего действия ионизирующего излучения.
Отдаленные последствия воздействия ионизирующей радиации на организм проявляются прежде всего:
ü в изменении продолжительности жизни;
ü в увеличении частоты возникновения злокачественных опухолей;
ü в росте числа генетических болезней.
Для животных достоверно доказано сокращение продолжительности жизни в результате воздействия ионизирующей радиации. Для человека доказать такую закономерность трудно из-за недостатка количества наблюдений. Однако и нет оснований отрицать факт сокращения сроков жизни, так как в организме после облученияпроисходит ряд необратимых явлений, которые неизбежно должны привести к более раннему старению:
ü нерепарируемые повреждения ДНК;
ü ослабление систем иммунитета;
ü дегенеративные изменения в эндокринной системе;
ü усиление склеротических процессов и др.
Доказано, что воздействие ионизирующего излучения на организм людей ведет к повышению риска опухолевых болезней. Установлено, что ионизирующее излучение может выступать в роли стимулирующего фактора на всех этапах канцерогенеза (возникновения и развития злокачественной опухоли):
ü в фазе инициации опухолевого роста (мутации в соматических клетках, трансформация клетки в потенциально опухолевую) вследствие поглощения лучевой энергии генетическими структурами клетки; в первую очередь это касается регуляторных генов, в том числе и латентного онкогена (проонкогена), и происходит как за счет непосредственного поражения его радиоактивным излучением, так и за счет нарушений стабильности генома, перемещения мобильных диспергированных генов (прыгающих генов);
ü в фазе промоции (усиление роста опухоли) в качестве пускового механизма деления;
ü на всех этапах канцерогенеза в качестве фактора, снижающего иммунный контроль.
Несмотря на то, что изучать генетические последствия облучения у людей сложно, уже накоплен материал, показывающий что:
ü доза в 1 Зв является удваивающей дозой (т.е. число мутаций возрастает в 2 раза по сравнению с воздействием естественного радиоактивного фона);
ü мутирование начинается при дозе 0,1 Р/сут (0,001 Зв);
ü летальные мутации начинают обнаруживаться уже при дозах 0,2 – 1 мР/ч (0,002 – 0,01 мЗв).
Знание основных патогенетических механизмов развития лучевого поражения на последовательных этапах позволяет разработать в каждом конкретном случае стратегию пострадиационного восстановления организма:
а) в период острого радиационного поражения, нарастания радиационно-физических и радиационно-химических процессов:
ü перехват и инактивация радикалов;
ü создание условий, благоприятных для работы ферментов репарации ДНК (введение коферментов);
ü создание условий, благоприятных для восстановления молекул ДНК (введение субстратов для синтеза);
ü выведение радиотоксинов;
ü создание гипотермии;
ü создание гипоксии;
б) в период вторичных нарушений биохимических процессов и опосредованного усиления радиационного эффекта, вторичного поражения генома и мембран:
ü перехват и создание условий для выведения радиотоксинов или условий, препятствующих их образованию;
ü ослабление активности протеаз и нуклеаз;
ü введение антиоксидантов или создание условий для их активации;
ü создание условий для ускорения синтеза и переноса липидов;
в) в период гибели радиочувствительных популяций клеток:
ü активация деления резервного пула (например, стимуляция кроветворения);
ü активация процессов регенерации;
ü введение сингенных (генетически сходных) клеток заменителей;
г) в случае усиления радиационного поражения генома при сочетанном воздействии других физических и химических факторов:
ü удаление физических и химических факторов, усиливающих радиобиологический эффект;
ü использование физических и химических факторов, ослабляющих радиобиологический эффект.
Микроэлементы, их значение для организма человека в современных экологических условиях
Микроэлементы – это не случайные ингредиенты тканей и жидкостей живых организмов, а компоненты закономерно существующей очень древней и сложной физиологической системы, участвующей в регулировании жизненных функций организмов на всех стадиях развития. Выделены три основополагающих принципа ее функционирования: 1) избирательное поглощение микроэлементов; 2) избирательная концентрация их в определенных организмах, органах, тканях и некоторых органеллах клетки; 3) селективная элиминация. Вероятно, эти механизмы поддерживают микроэлементный гомеостаз (А.П. Авцын, 1972).
До тех пор, пока реакции организма в ответ на изменения концентраций микроэлементов в среде не выходят за пределы нормы реакции, организм сохраняет гомеостаз, в противном случае развивается экопатология (нарушаются адаптационные механизмы, происходят разбалансирование ферментативных процессов, изменения метаболических превращений).
В настоящее время введен термин микроэлементоз(А.П. Авцын с соавт., 1991), объединяющий все патологические процессы, вызванные избытком, дефицитом или дисбалансом микроэлементов. В основу их классификации положен принцип, согласно которому на первое место выдвигаются этиологический фактор и характер его проявления. Это выражено в названиях микроэлементозов:
ü если имеется в виду дефицит микроэлементов, то микроэлементоз трактуется как дефицитное состояние по названию элемента: купродефициты, цинкдефициты, хромдефициты, селендефициты и т.д. Употребляются также названия типа гипоиодоз или гипоидное состояние, гипосидероз или сидеропеническое заболевание;
ü если речь идет о микроэлементной токсикопатии (микроэлементном токсикозе), то и название микроэлементоза образуется для каждого микроэлемента соответственно с добавлением слова "токсикоз": Al-токсикоз, Cd-токсикоз, Hg-токсикоз, Рb-токсикоз и т.д. При этом сохраняются и такие названия, как меркуриализм, плюмбизм и др.
Микроэлементы с учетом выполняемых ими функций в организме подразделяются на эссенциальные, условно эссенциальные, условно токсичные и токсичные (Aggett P.I., 1985).
Согласно современным представлениям, ряд микроэлементов является абсолютно необходимым (эссенциальным) для организма, оптимального состояния его здоровья. К ним относятся железо (Fe), медь (Cu), цинк (Zn), марганец (Mn), хром (Cr), селен (Se), молибден (Mo), кобальт (Со), йод (J2). Микроэлементы входят в состав общей регуляторной системы организма, поддерживающей его гомеостаз. Они влияют на оплодотворение, развитие, рост, жизнеспособность организма, его иммунологические свойства, дыхательную функцию гемоглобина и прочие важнейшие функции.
Влияние микроэлементов на обменные процессы реализуется, прежде всего, через их воздействие на генетический аппарат клетки. Связываясь с нуклеотидами, ионы металлов вызывают существенные изменения в структуре нуклеиновых кислот. Так, Zn, Mg и Мn входят в состав ДНК- и РНК-полимераз, обратной транскриптазы, т-рНК-синтетазы, фактора инициации трансляции и др.). Отсутствие металлов ведет к дестабилизации двойной спирали ДНК и ее частичной денатурации. Присоединение металлов может ослабить электростатическое отталкивание между цепями ДНК; привести к разрыву водородных связей между парами азотистых оснований; Сr и Fe могут включаться в структуру ДНК, образуя поперечные сшивки между нитями, и видоизменять ее структуру.
Поэтому дефицит, избыток и дисбаланс микроэлементов в организме человека может приводить к различным генетическим нарушениям на уровне гамет (гаметопатиям) в виде генных, хромосомных или геномных мутаций. Нарушение обмена микроэлементов (как недостаток их, так и избыток) в организме беременной женщины может вызывать различные пороки развития (таблица 18).
Таблица 18.
Врожденные пороки развития при дефиците и избытке микроэлементов
| Микроэлемент | Врожденное нарушение |
| Дефицит микроэлемента | |
| Zn | Бесплодие, хромосомные аномалии, смерть плода, микро – и анофтальмия, синдактилия, дефекты формирования нервной трубки, аномалии скелета, нарушение иммунных функций |
| Cu | Анемия, бесплодие, смерть плода, спастические параличи, ломкость костей, сердечная недостаточность, аневризмы, дефекты соединительной ткани, аномалии кожи и волос, низкая масса тела при рождении |
| Mn | Хондродистрофия, куполообразный череп, атаксия, склонность к конвульсиям |
| Fe | Бесплодие, смерть плода, низкая масса тела при рождении, функциональные нарушения иммунитета, аномалии развития скелета, задержка психомоторного развития, глухонемота, врожденная миксидема |
| Se | Гибель плода |
| Избыток микроэлемента | |
| Zn | Эмбриоцидное действие и перинатальная смерть |
| Cu | Эмбриоцидное действие |
| Mn | Эмбриоцидное действие |
| Pb | Стерильность, некроз плаценты,выкидыши, перинатальная и неонатальная смертность, замедление роста, аномалии поведения в результате нейротоксического действия |
| Cd | Хромосомные аномалии, эмбриотоксичекое действие, аномалии развития нервной трубки, строения лица, изменения скелета |
| As | Дефекты формирования нервной трубки, аномалии скелета и мочеполовой системы, замедление роста |
| Se | Эмбриотоксическое действие, аномалии скелета и конечностей, дефекты формирования глаз |
| Li | Расщепление неба, аномалии глаз и уха, поражение печени |
| Fe | Аномалии поведения (нейротоксическое действие), нарушение иммунных функций |
В разные периоды онтогенеза механизмы развития микроэлементозов могут быть различными. С одной стороны, в период внутриутробного развития происходит физиологическое накопление в организме плода многих микроэлементов, что обеспечивает интенсивность метаболических процессов, быстрый рост и развитие. С первых месяцев жизни наступает уменьшение этого резерва. Среди детей существуют группы риска, в которых довольно часто встречаются дефициты микроэлементов (гипотрофия и недоношенность; продолжительное парентеральное питание; рецидивирующая диарея; длительный катаболизм, синдром короткого кишечника; низкая концентрация микроэлементов в грудном молоке и др.). Сдругой стороны, избыток определенных микроэлементов может привести к различным эмбриотоксическим эффектам, вплоть до гибели плода.
Процессы метаболизма происходят при участии многих металлоферментов (металл прочно связан с белком-ферментом и незаменим), либо специфически активируются (или подавляются) с помощью микроэлементов. Имеются данные о прямом участии микроэлементов, например, кальция в молекуле амилазы слюны и формировании активного центра и всей трехмерной структуры молекулы этого фермента (Березов Т.Т. с соавт., 1990). Поэтому недостаток или избыток таких микроэлементов сопровождается целым каскадом метаболических нарушений.
Вместе с тем каждый элемент имеет присущий ему диапазон безопасной экспозиции, который поддерживает определенные тканевые концентрации и функции; у каждого микроэлемента есть также свой токсический диапазон, когда безопасная степень его экспозиции превышена.
Дефицит многих микроэлементов связан не только с недостаточным поступлением их в организм, но и с интенсивностью их всасывания, с неполноценностью транспорта и метаболизма, с нарушением активности специфических лигандов и клеточных рецепторов, с деятельностью многих систем организма. С другой стороны, относительный дефицит может возникать для одних элементов в результате дисбаланса с другими. Микроэлементные токсикозы – реальное явление в современных экологических условиях, результат постоянного загрязнения сред жизни вследствие выбросов в атмосферу солей и оксидов металлов, оксидов серы и азота.
Различают мономикроэлементозы– заболевания, обусловленные избытком или недостатком одного микроэлемента, и полимикроэлементозы– заболевания, в этиологии которых существенную роль играют несколько микроэлементов или дисбаланс с несколькими микроэлементами. К ним относятся такие массовые заболевания, как кариес зубов, широко распространенная группа мочекаменных болезней, гетерогенная по патогенезу группа эндемического зоба, группа анемий сложной биохимической природы и др.
Выделяется также вторичный микроэлементоз, который присоединяется к основному заболеванию на различных стадиях его течения или может иметь ятрогенное происхождение (быть следствием различных медицинских воздействии, например, хирургических операций на желудочно-кишечном тракте, когда повреждаются зоны всасывания микроэлементов, неконтролируемого лечения препаратами, содержащими металлы, может развиваться при тяжелых гельминтозах, таких как описторхоз, дифиллоботриоз).
Одной из особенностей микроэлементов является их способность накапливаться в организме. Поэтому перенасыщение ими воздуха, воды и почвы может привести к значительным концентрациям их в организме человека.
Часть микроэлементов является условно эссенциальными: мышьяк (As), бор (В), бром (Br), фтор (F), литий (Li), никель (Ni), кремний (Si), ванадий (V). Для них не установлены дефицитные состояния человека. Патологические механизмы микроэлементозов в этих случаях связаны в основном с избытком таких микроэлементов, с различными токсикозами как острого, так и хронического характера.
Существует группа токсичных и условно-токсичных микроэлементов: алюминий (Al), кадмий (Cd), свинец (Pb), ртуть (Hg), бериллий (Be). Для них также не установлены дефицитные состояния у человека. Накопление их в организме приводит к различным токсикозам полиморфного характера с поражением разных органов и систем.
Ряд микроэлементов образует пары или триады, которые оказывают синергическое или антагонистическое действие на различные физиологические и патологические показатели: Си и Zn, Fe и Мn, Fe и Zn, Cd и Сu. Кроме того, установлены взаимодействия для Сu, Мо и S04 2-; F, Са и РО43-, т.е. проблема взаимодействия микроэлементов выходит за пределы только этой группы веществ и связывается с активностью ряда макроэлементов.
В развитии недостатка или избытка содержания микроэлементов в организме человека важную роль играют природные и промышленные факторы, возможность усвояемости микроэлементов организмом, поэтому микроэлементозы в организме человека разделены на следующие группы:
ü природные – обусловленные содержанием микроэлементов в окружающей среде. В естественных условиях встречаются районы, где вследствие повышенного или пониженного содержания микроэлементов в почве и других объектах окружающей среды наблюдаются эндемии. Механизм развития эндемических заболеваний следующий: недостаток или избыток микроэлементов в почве и других объектах окружающей среды ведет к дефициту или избытку их в пищевом рационе, а отсюда и в организме. Наиболее изучены и известны два микроэлемента, являющиеся причиной эндемических расстройств у человека: это фтор, избыточное поступление которого приводит к флюорозу, и йод, недостаточность которого способствует возникновению и распространению эндемического зоба.
ü промышленные– преимущественно бывают гипермикроэлементозы, обусловленные вредными условиями производства. Примером могут служить острые и хронические отравления свинцом, кадмием, ртутью и другими химическими элементами, вызванные избыточным содержанием в организме человека.
ü ятрогенные – расстройства, возникающие как следствие деонтологических ошибок. Неправильное истолкование слов медицинских работников могут привести к отказу или, наоборот, к чрезмерному приему тех или иных препаратов, содержащих микроэлементы, что может вызвать гипо- и гипермикроэлементозы.
ü эндогенные – в результате наследственного или врожденного нарушения усвояемости или повышенной способности к накоплению одного или нескольких микроэлементов в организме человека. Также существует зависимость всасывания и усвоения микроэлементов от заболеваний желудочно-кишечного тракта (Авцын А.П. с соавт., 1991).
Микроэлементный статус тесно связан с возникновением и прогрессированием злокачественных опухолей. При всех формах рака в крови снижено количество Fe. Повышение частоты онкологических заболеваний связывается с дефицитом Mg, Se, Mo и, напротив, с повышенным уровнем As, Cd, Ni, Cu, Mn, V, Sr, сульфатов.
Важнейшие приобретенные микроэлементозы человека представлены в таблице 19.
Таблица 19.
Важнейшие приобретенные микроэлементозы у человека
| Микроэлемент | Важнейшие заболевания, синдромы и признаки | ||
| дефицита | избытка | ||
| эссенциальных микроэлементов | |||
| Fe | Гипохромная анемия, атрофический ринит, гастрит, гингивит и хейлит; железодефицитная эзофагопатия; трофические изменения ногтей | Сидерозы сердца, легких, поджелудочной железы, глаз; липомиодистрофия на месте внутримышечных иньекций препаратов железа | |
| Co | Пернициозная анемия при инвазии лентецом широким | Профессиональные поражения органов дыхания, кроветворения, сердечно-сосудистой и нервной систем. Аллергический дерматит. Хронический бронхит. Кобальтовая миокардиопатия, гиперплазия щитовидной железы, миокардиодистрофия | |
| Cu | Медьдефицитные анемии, коллагенопатии (аневризмы); медьдефицитные заболевания скелета и суставов | Отравление медьсодержащими препаратами; профессиональный гипертериоз, гемодиализный гипертиреоз | |
| Mn | Диабет, нечувствительный к инсулину; гипохолестеринемия | Техногенные манганозы | |
| Cr | Снижение толерантности к глюкозе, повышение концентрации инсулина в крови; задержка роста; периферические невропатии; нарушение высшей нервной деятельности; снижение оплодотворяющей способности и подвижности спермиев | Действие: общетоксическое, нефротоксическое, гепатотоксическое, канцерогенное, мутагенное | |
| Se | Алиментарный дефицит в эндемических районах: фактор риска возникновения и смертности от злокачественных новообразований желудка, кишечника, молочной железы, яичников, простаты, легких | Повреждение эмали зубов, анемии, нервные расстройства, поражение ногтей и волос | |
| Mo | Не найдено данных | Хронический профессиональный молибденоз, заболевания суставов, анемия, лейкопения | |
| I2 | Гипертиреоз под влиянием зобогенных веществ; эндемический зоб, микседема у взрослых; длительно протекающий гипойодоз у детей | Профессиональные и ятрогенные интоксикации йодидами; йодизм – аллергическая реакция на контакт с йодом | |
| Zn | Нарушение клубочковой фильтрации и канальцевой реабсорбции при серповидно-клеточной анемии; нарушение вкуса и отопатия; дерматит при хронических заболеваниях ЖКТ, после гастроэктомии | Отравление содержащими соединениями | |
| условно – эссенциальных микроэлементов | |||
| As | Дефицитные состояние не известны | Диспепсические расстройства, помутнение стекловидного тела и роговицы, стоматиты, ларингиты, трахеиты, бронхиты, рецидивирующая экзема, ломкость ногтей, неврологические нарушения | |
| B | Дефицитные состояния у человека не зарегистрированы | Острая интоксикация соединениями бора (нейропатия, некроз, ожирение печени); борный энтерит – эндемическое заболевание желудочно-кишечного тракта | |
| Br | Дефицитные состояния у человека не зарегистрированы | Острое и хроническое отравление бромом (катаральный ринит, бронхит, энтерит); бромодерма – специфическое поражение кожи лица | |
| F | Гипофтороз – типичный кариес зубов в эндемических зонах; фторзависимый остеопороз скелета | Эндемический флюороз зубов, костей скелета; фторный гепатоз; миокардиодистрофия | |
| Li | У человека не описаны | Отравления аэрозолями лития: трахеит, бронхит, ожоги кожи и слизистых; неврологический синдром (сонливость, головокружение, боль при глотании и др.) | |
| Ni | У человека не описаны | Нарушение подвижности сперматозоидов, увеличение щитовидной железы; профессиональные интоксикации (лихорадка, недомогание, слабость, отек легких, гепатит, изъязвление слизистой носа, никелевый рак слизистой носа, придаточных полостей, легких) | |
| Si | Сведений у человека не имеется | Гиперсиликоз при избыточном поступлении кремния и при нарушении его экскреции; локальные формы силикоза – пневмокониоз, нефросиликоз | |
| V | У человека не описаны | V2O5 вызывает выраженное токсическое действие на дыхательную, сердечно-сосудистую системы, печень, почки | |
Концентрация элементов в живом веществе прямо пропорциональна содержанию их в среде обитания с учетом растворимости их соединений. Согласно учению А.П. Виноградова (1933), которому принадлежат фундаментальные труды об элементном составе различных видов растений и животных, химический состав организма есть его признак – видовой, родовой и др. Различные области земной поверхности различаются по элементному составу, что приводит к различию в содержании микроэлементов в организмах и своеобразным биологическим реакциям в ответ на эти различия. Эти представления лежат в основе учения о биогеохимических провинциях и биогеохимической патологии (эндемических болезнях), которое разработано детально В.В. Ковальским.
Биогеохимические провинции – это области на поверхности Земли, различающиеся по содержанию в почвах, водах и других средах химических элементов или их соединений, с которыми связаны определённые биологические реакцииу растений, животных и человека. Основой выделения биогеохимической провинции является отклонение содержания элементов в земной коре от среднего значения (кларка). Термин «биогеохимическая провинция» был введен в науку в 1938 году А.П. Виноградовым.
На территории России выделяются следующие биогеохимические регионы биосферы, представляющие собой совокупности нескольких биогеохимических провинций (В.В. Ковальский, 1974):
ü таежно-лесной нечерноземный – биологические реакции организмов обусловлены недостатком кальция, фосфора, кобальта, меди, йода, бора, молибдена, цинка, достаточным, в некоторых случаях избыточным, количеством марганца, повышенным содержанием стронция, особенно в поймах рек;
ü лесостепной, степной черноземный – биологические реакции организмов определяются достаточным, реже избыточным, количеством кальция, достаточным количеством кобальта, меди, йода, иногда недостатком калия, марганца и часто недостатком фосфора.
Черноземы принято считать почвами оптимального микроэлементного состава, своего рода эталонами. Однако при детальном изучении оказалось, что это не совсем так. В определенных геохимических условиях даже плодородные черноземы могут испытывать недостаток или избыток тех или иных микроэлементов или их подвижных форм. Например, по сравнению с кларком (средним, нормальным содержанием в почвах) черноземы ЦЧР имеют дефицит таких микроэлементов, как бериллий, стронций, ванадий, хром, подвижных форм цинка и молибдена (Н.А. Протасова, 1998).
ü сухостепной, полупустынный, пустынный – биологические реакции организмов связаны с повышенным содержанием сульфатов, бора, цинка, часто стронция, иногда молибдена, недостатком меди, иода, марганца, в некоторых случаях – избытком нитритов и нитратов;
ü горные регионы – биологические реакции организмов разнообразны и определяются изменчивой концентрацией и соотношением многих геохимических элементов, недостатком йода, иногда кобальта, меди, цинка, избытком молибдена, меди, свинца, цинка, стронция и других элементов. Среди заболеваний отмечаются различные эндемичные болезни, химическая и морфологическая изменчивость организмов, эндемичный зоб, гипо- и авитаминозы.
Кроме биохимических провинций и регионов, выделяются также субрегионы. Отдельную группу составляют биогеохимические провинции, характеризующиеся по какому-либо одному элементу (например, недостаток или избыток железа).
Содержание микроэлементов в окружающей среде имеет большое значение для организма человека. Знание аномальных в биогеохимическом отношении регионов и провинций природного происхождения как источников биогеохимических эндемийочень важно для эпидемиологической оценки этих очагов, разработки научно обоснованных методов профилактики таких болезней. Однако в последнее время еще более остро встала проблема техногенных эндемий, заболеваний антропогенного происхождения. Существенные наблюдения накоплены фитопатологами и специалистами по болезням животных. Они показывают, что микроэлементные загрязнения сред жизни по своему значению начинают приобретать характер «лимитирующих факторов», которые угрожают не только нормальному развитию, но и самому существованию различных видов живых существ (Ю. Одум, 1975)
Микроэлементные загрязнения окружающей среды представляют большую опасность в индустриально развитых городах, где в результате деятельности человека образуются техногенные биогеохимические провинции. Это территории с аномально высоким содержанием нитратов в колодезной и грунтовой воде, районы, в которых произошло оседание радионуклидов в результате аварии на Чернобыльской АЭС или в которых сосредоточены предприятия машиностроительной и приборостроительной промышленности, где в почвах аномально высокое содержание свинца, бора, никеля, меди, ванадия, вольфрама, хрома и других металлов. Микроэлементные загрязнения возникают и на значительном отдалении от предприятий в результате переноса загрязнителей воздушными массами и водными потоками. Такой перенос может быть эпизодическим (например, в результате катастроф), но может быть и постоянным (например, кислотные дожди, выпадения оксидов серы и азота) и носит не только локальный, но и глобальный характер.
В условиях микроэлементных загрязнений происходит накопление различных токсичных элементов в плаценте, волосах, органах эндокринной системы. Происходят явления дезадаптации, нарушения физического и психического развития, диспластические изменения скелета и другие нарушения.
Из всех микроэлементов необходимо выделить стронций, хром и бериллий, которые находятся в дефиците во всех почвах ЦЧР. Исследования микроэлементного состава почв выявили положительную корреляционную связь между содержанием в почве стронция и распространением гипертонической болезни; стронция, титана, хрома, никеля и ишемической болезни сердца у жителей Тамбовской области. Также установлена прямая зависимость между содержанием йода в почвах области и распространением облитерирующего эндартериита (заболевания сосудов), стронция – и болезни крови и кроветворных органов (Н.А.Протасова, И.М. Голубев, 1998). Исследованиями В.П. Ситниковой, В.Н. Пенкина и Т.Л. Настаушевой (1993) выявлены высокие коэффециенты корреляции для частоты встречаемости нефропатий и содержания в почве ванадия, стронция, галлия, кобальта и молибдена в п. Грибановка Воронежской области.
Помимо этого с питьевыми водоисточниками население Центрального Черноземья получает избыточное содержание марганца, железа и кальция и недостаточное количество йода во всех областях региона, фтора в Воронежской Курской и Липецкой областях.
В связи с вышеперечисленным на территории Центрального Черноземья выделяют ряд эндемических заболеваний. К ним относится патология щитовидной железы и мочекаменная болезнь (уролитиаз).
Дефицит йода в почве и воде, а, следовательно, и в пищевых продуктах растительного и животного происхождения приводит к развитию у жителей региона йододефицитных расстройств. Исследования по изучению распространенности заболеваний щитовидной железы среди детского населения города Воронеж показали, что частота увеличения щитовидной железы по показателям ультрасонографии составляет 9,3% и превышает спорадический уровень заболеваемости в 1,9 раза, что свидетельствует о легкой степени эндемии. Результаты скрининга новорожденных на гипотиреоз указывают на среднетяжелую эндемию (М.И. Чубирко, Н.М. Пичужкина, Л.А. Масайлова, И.С. Подрезова, 2012). Йодная недостаточность особо опасна для школьников начальных классов, когда психоэмоциональная нагрузка на ребенка особенно высока. Дефицит йода приводит к ослаблению памяти, функции внимания, способности быстро и правильно выполнять задания, нарушается умственное и физическое развитие, становление репродуктивной функции. Ребенок начинает резко отставать в психическом развитии. В далеко зашедших случаях развивается эндемический зоб. Доказано, что для проявления зобной эндемии очень важно соотношение содержания в почве йода с другими элементами: Со, Мо, Сu, Zn, Мn (В.В. Ковальский,1974). Работы Е.П. Новиковой (1963, 1965), И.И. Швайко, И.Н. Цветковой (1977) подтверждают зобогенную роль Со, а исследования И.Н. Аксюк (1966), Э.С. Турищевой (1972) – зобогенное действие Мn.
Важным свойством щитовидной железы при дефиците в рационе йода является ее способность к повышенному его поглощению. Это особенно опасно при ситуациях, когда окружающая среда заражена радиоактивным йодом, что наблюдалось при аварии на Чернобыльской АЭС. Неблагоприятным последствием этого может быть злокачественная опухоль щитовидной железы. В таких ситуациях чрезвычайно важно в первые же часы после катастрофы обеспечить организм этим элементом и тем самым не дать возможности радиоактивному йоду накопиться в щитовидной железе.
Использование для питья жёсткой воды с большим содержанием в ней растворенных солей магния (Mg) и кальция (Ca) может способствовать развитию уролитиаза (мочекаменной болезни). Наибольшая заболеваемость отмечается в регионах, где питьевая вода имее<
Дата добавления: 2021-11-16; просмотров: 644;











