Изомерия ароматических углеводородов.
В 1825 году английский исследователь Майкл Фарадей выделил пахучее вещество, которое имело молекулярную формулу C6Н6. Это соединение, называемое теперь бензолом, является простейшим ароматическим углеводородом.
Распространенная структурная формула бензола, предложенная в 1865 году немецким ученым Кекуле, представляет собой цикл с чередующимися двойными и одинарными связями между углеродными атомами:

Однако физическими, химическими, а также квантово-механическими исследованиями установлено, что в молекуле бензола нет обычных двойных и одинарных углерод–углеродных связей. Все эти связи в нем равноценны, эквивалентны, т.е. являются как бы промежуточными "полуторными " связями, характерными только для бензольного ароматического ядра.
Оказалось, кроме того, что в молекуле бензола все атомы углерода и водорода лежат в одной плоскости, причем атомы углерода находятся в вершинах правильного шестиугольника с одинаковой длиной связи между ними, равной 0,139 нм, и все валентные углы равны 120о. Такое расположение углеродного скелета связано с тем, что все атомы углерода в бензольном кольце имеют одинаковую электронную плотность и находятся в состоянии sp2 - гибридизации. Это означает, что у каждого атома углерода одна s- и две p-орбитали гибридизованы, а одна p-орбиталь негибридная. Три гибридных орбитали перекрываются: две из них с такими же орбиталями двух смежных углеродных атомов, а третья – с s-орбиталью атома водорода.
Подобные перекрывания соответствующих орбиталей наблюдаются у всех атомов углерода бензольного кольца, в результате чего образуются двенадцать σ-связей, расположенных в одной плоскости. Четвертая негибридная гантелеобразная p-орбиталь атомов углерода расположена перпендикулярно плоскости направления σ-связей. Она состоит из двух одинаковых долей, одна из которых лежит выше, а другая - ниже упомянутой плоскости. Каждая p-орбиталь занята одним электроном. р- Орбиталь одного атома углерода перекрывается с p-орбиталью соседнего атома углерода, что приводит, как и в случае этилена, к спариванию электронов и образованию дополнительной π-связи.
Однако в случае бензола перекрывание не ограничивается только двумя орбиталями, как в этилене: р-орбиталь каждого атома углерода одинаково перекрывается с p-орбиталями двух смежных углеродных атомов. В результате образуются два непрерывных электронных облака в виде торов, одно из которых лежит выше, а другое – ниже плоскости атомов (тор – это пространственная фигура, имеющая форму бублика или спасательного круга). Иными словами, шесть р-электронов, взаимодействуя между собой, образуют единое π-электронное облако, которое изображается кружочком внутри шестичленного цикла:

Согласно правила Хюккеля, ароматическими соединениями могут называться только такие циклические соединения, которые имеют плоское строение и содержат в замкнутой системе сопряжения (4n+2) p-электронов, где n – целое число. Например, бензол. Его число шесть p-электронов является числом для n=1, в связи с чем, шесть p-электронов молекулы бензола называют «ароматическим секстетом".
Общая формула ароматических углеводородов CnH2n-6.
Примером ароматических систем, содержащих 10 и 14 p-электронов являются представители многоядерных ароматических соединений –
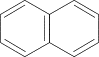 и
и 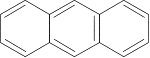
нафталин антрацен
Теоретически допускает существование только одного соединения с формулой бензола (C6H6) а также только одного ближайшего гомолога – толуола (C7H8). Однако последующие гомологи могут уже существовать в виде нескольких изомеров. Изомерия обусловлена изомерией углеродного скелета имеющихся радикалов и их взаимным положением в бензольном кольце. Положение двух заместителей указывают с помощью приставок: орто- (о-), если они находятся у соседних углеродных атомов углерода (положение 1, 2), мета- (м-) для разделенных одним атомом углерода (1, 3) и пара- (п-) для находящихся напротив друг друга (1, 4).
Например, для диметилбензола (ксилола):
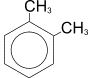
орто-ксилол (1,2-диметилбензол)
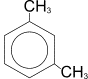
мета-ксилол (1,3-диметилбензол)

пара-ксилол (1,4-диметилбензол)
Дата добавления: 2021-10-28; просмотров: 643;











