Химические свойства ароматических соединений
Бензольное ядро обладает высокой прочностью, чем и объясняется склонность ароматических углеводородов к реакциям замещения. В отличие от алканов, которые также склонны к реакциям замещения, ароматические углеводороды характеризуются большой подвижностью атомов водорода в ядре, поэтому реакции галогенирования, нитрования, сульфирования и др. протекают в значительно более мягких условиях, чем у алканов.
5.1. Электрофильное замещение в бензоле
Несмотря на то, что бензол по составу является ненасыщенным соединением, для него нехарактерны реакции присоединения. Типичными реакциями ароматических соединений являются реакции замещения атомов водорода – реакции электрофильного замещения.
Рассмотрим примеры наиболее характерных реакций этого типа.
5.1.1. Галогенирование.
При взаимодействии бензола с галогеном (в данном случае с хлором) атом водорода ядра замещается галогеном.
 + Cl2 à
+ Cl2 à 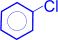 + H2O
+ H2O
(хлорбензол)
Реакции галогенирования осуществляются в присутствии катализатора, в качестве которого чаще всего используют хлориды алюминия или железа.
Рассмотрим механизм реакции электрофильного замещения в ряду бензола на примере реакции хлорирования.
Первичной стадией является генерирование электрофильной частицы. Она образуется в результате гетеролитического расщепления ковалентной связи в молекуле галогена под действием катализатора и представляет собой хлорид-катион.
Cl:Cl + AlCl3 à Cl+ + AlCl4-
Образующаяся электрофильная частица атакует бензольное ядро, приводя к быстрому образованию нестойкого π- комплекса, в котором электрофильная частица притягивается к электронному облаку бензольного кольца.
 + Cl+ à
+ Cl+ à  Cl+
Cl+
π-комплекс
Иными словами, π-комплекс – это простое электростатическое взаимодействие электрофила и π-электронного облака ароматического ядра.
Далее происходит переход π-комплекса в σ-комплекс, образование которого является наиболее важной стадией реакции. Электрофильная частица "захватывает" два электрона p-электронного секстета и образует σ-связь с одним из атомов углерода бензольного кольца.
 Cl+ à
Cl+ à 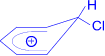
σ-комплекс
σ- Комплекс – это катион, лишенный ароматической структуры, с четырьмя p-электронами, делокализованными (иначе говоря, распределенными) в сфере воздействия ядер пяти углеродных атомов. Шестой атом углерода меняет гибридное состояние своей электронной оболочки от sp2 до sp3, выходит из плоскости кольца и приобретает тетраэдрическую симметрию. Оба заместителя – атомы водорода и хлора располагаются в плоскости, перпендикулярной к плоскости кольца.
На заключительной стадии реакции происходит отщепление протона от σ- комплекса и ароматическая система восстанавливается, поскольку недостающая до ароматического секстета пара электронов возвращается в бензольное ядро.
 à
à 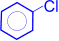 + H+
+ H+
Отщепляющийся протон связывается с анионом четыреххлористого алюминия с образованием хлористого водорода и регенерацией хлорида алюминия.
H+ + AlCl4- à HCl + AlCl3
Именно благодаря такой регенерации хлорида алюминия для начала реакции необходимо очень небольшое (каталитическое) его количество.
5.1.2. Нитрование.
При действии на бензол нитрующей смеси атом водорода замещается нитрогруппой (нитрующая смесь – это смесь концентрированных азотной и серной кислот в соотношении 1:2 соответственно).
 + HNO3 à
+ HNO3 à  + H2O
+ H2O
(нитробензол)
Серная кислота в данной реакции играет роль катализатора и водоотнимающего средства.
5.1.3. Сульфирование.
Реакция сульфирования осуществляется концентрированной серной кислотой или олеумом (олеум – это раствор серного ангидрида в безводной серной кислоте). В процессе реакции водородный атом замещается сульфогруппой, приводя к моносульфокислоте.
 + H2SO4 à
+ H2SO4 à  + H2O
+ H2O
(бензолсульфокислота)
5.1.4. Алкилирование (реакция Фриделя-Крафтса).
При действии на бензол алкилгалогенидов в присутствии катализатора (хлористого алюминия) осуществляется замещение R-углеводородным радикалом атома водорода бензольного ядра.
 + R–Cl à
+ R–Cl à  + HCl
+ HCl
(R-углеводородный радикал)
Следует отметить, что реакция алкилирования представляет собой общий способ получения гомологов бензола - алкилбензолов.
Дата добавления: 2021-10-28; просмотров: 494;











