ТЕПЛОВЫЕ СВОЙСТВА ГАЗОВ
Теплоемкость. Для газов различают теплоемкость, определяемую при постоянном давлении (изобарная теплоемкость) ср и при постоянном объеме (изохорная теплоемкость) сv. Эти теплоемкости идеальных газов связаны между собой соотношением с0р – с0v= R. Здесь индекс 0 означает нормальное давление. Как и для жидких нефтепродуктов
(см. § 1.6), теплоемкость газов может быть молярной, массовой и объемной.
В технологических расчетах преимущественно используются изобарные теплоемкости газов, значения которых при нормальных условиях приведены в прил.16. Теплоемкость газов слабо зависит от давления, обычно этим влиянием в расчетах пренебрегают. При повышении температуры теплоемкость газов увеличивается. Однако в меньшей степени, чем для жидких нефтепродуктов.
На рис.2.6 приведен график зависимости теплоемкости ср углеводородных газов и нефтяных паров от их относительной плотности и температуры.
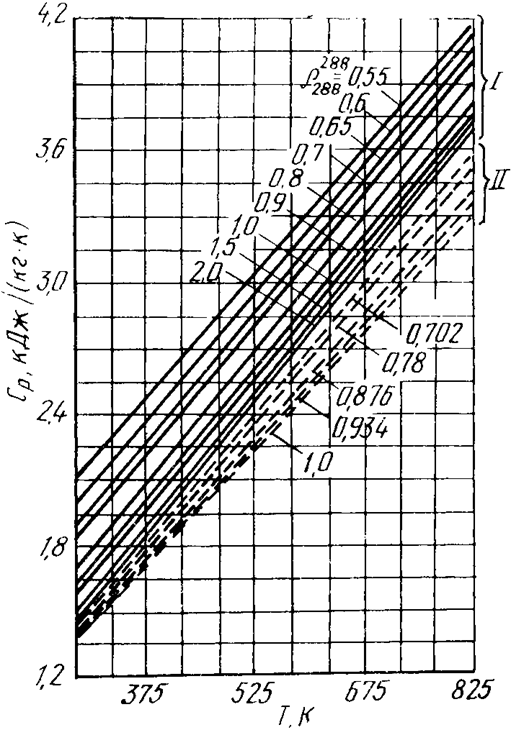
Рисунок 2.6 – Зависимость теплоемкости паров углеводородов от температуры и их плотности по отношению к воздуху (I) и от паров жидких углеводородов по отношению к воде (II)
Приближенно теплоемкость насыщенных газообразных углеводородов в килоджоулях на киломоль-кельвин можно определить как функцию числа углеводородных атомов Nс в молекуле с учетом температуры
Т [1]: ср = 16,74 + 5,44Nс + 0,05NcТ.
Теплоемкость реальных газов рассчитывается по формуле
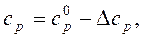 (2.7)
(2.7)
где 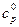 – изобарная теплоемкость газа или газовой смеси в расчете на идеальный газ, кДж/(кг·К);
– изобарная теплоемкость газа или газовой смеси в расчете на идеальный газ, кДж/(кг·К); 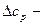 поправка к теплоемкости, учитывающая неидеальность газа, кДж/(кг·К).
поправка к теплоемкости, учитывающая неидеальность газа, кДж/(кг·К).
Теплоемкость газов (как идеальных) определяется по уравнению
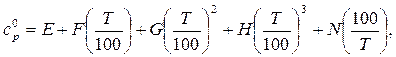 (2.8)
(2.8)
где Е, F, G, Н, N – коэффициенты.
Значения коэффициентов F, G, H, N приведены в табл.2.2. Для рассматриваемых газов Е=0.
Таблица 2.2 – Значения коэффициентов к уравнению (2.8), кДж/(кг·К)
| Газы | F·102 | -G·103 | Н·105 | N·10 |
| Водород | 329,83 | 294,05 | 940,12 | 200,39 |
| Кислород | 21,62 | 16,46 | 45,44 | 12,05 |
| Азот | 21,74 | 16,13 | 45,18 | 15,43 |
| Оксид углерода | 22,07 | 16,19 | 44,59 | 15,20 |
| Диоксид углерода | 25,75 | 19,43 | 53,59 | 6,92 |
| Диоксид серы | 19,10 | 15,48 | 43,24 | 5,11 |
| Сероводород | 24,41 | 16,68 | 45,82 | 11,68 |
| Водяной пар | 40,15 | 27,80 | 79,22 | 26,41 |
| Метан | 58,43 | 15,19 | -2,94 | 18,55 |
| Этилен | 58,31 | 31,71 | 68,49 | 2,36 |
| Этан | 62,46 | 25,62 | 35,94 | 3,34 |
| Пропилен | 57,38 | 28,87 | 56,17 | 1,54 |
| Пропан | 66,22 | 32,71 | 62,19 | -0,78 |
| Бутилен | 61,06 | 33,12 | 70,58 | -0,50 |
| Бутан | 65,71 | 33,13 | 64,19 | |
| Пентан | 65,66 | 33,76 | 66,84 | -6,11 |
Поправка теплоемкости на давление рассчитывается по формуле
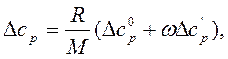 (2.9)
(2.9)
где 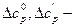 поправки, определяемые по графикам (прил.17 и 18) в зависимости от приведенных давления и температуры; w - фактор ацентричности.
поправки, определяемые по графикам (прил.17 и 18) в зависимости от приведенных давления и температуры; w - фактор ацентричности.
Фактор ацентричности w находится приближенно по формуле w=0,1745+0,0838Тпр или по табл.2.3.
Таблица 2.3 – Значения фактора ацентричности для некоторых газов
| Газ | w | Газ | w |
| Водород | 0,0 | Метан | 0,0104 |
| Диоксид углерода | 0,2310 | Этан | 0,0986 |
| Сероводород | 0,1000 | Пропан | 0,1524 |
| Диоксид серы | 0,2460 | Бутан | 0,2010 |
| Водяной пар | 0,3480 | Пентан | 0,2539 |
Фактор ацентричности газовых смесей подсчитывается по правилу аддитивности, состав смеси при этом выражается в молярных долях. Правило аддитивности действует и при расчете теплоемкости газовой смеси.
Энтальпия. Энтальпия газов или паров при заданной температуре Т численно равна количеству теплоты в джоулях (килоджоулях), которое необходимо затратить на нагрев единицы количества вещества от температуры Т1 до Т2 с учетом теплоты испарения и перегрева газов или паров.
Для подсчета энтальпии нефтяных паров (см. § 1.6) применяется формула (1.17). Энтальпия идеального газа ( 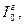 кДж/кг) при температуре Т и атмосферном давлении рассчитывается по уравнению
кДж/кг) при температуре Т и атмосферном давлении рассчитывается по уравнению
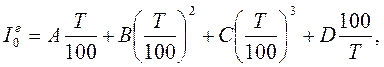
где А, В, С, D – коэффициенты, значения которых для газов приведены в табл. 2.4.
Таблица 2.4 – Значения коэффициентов к уравнению (2.10), кДж/кг
| Газы | А | В | С | D |
| Водород | 82,27 | 2,54 | 0,013 | 25,12 |
| Кислород | 82,72 | 1,87 | 0,032 | 24,37 |
| Диоксид углерода | 58,62 | 5,05 | 0,012 | -11,08 |
| Сероводород | 1429,21 | -1,32 | 0,316 | -167,44 |
| Метан | 154,15 | 15,12 | 0,051 | 59,62 |
| Этилен | 66,94 | 18,77 | 0,352 | 49,12 |
| Этан | 58,65 | 23,63 | 0,414 | 56,15 |
| Пропилен | 40,57 | 21,94 | 0,450 | 52,30 |
| Пропан | 33,65 | 26,31 | 0,538 | 35,58 |
| Бутилен | 35,38 | 23,15 | 0,491 | 25,63 |
| изо-Бутан | 27,32 | 27,08 | 0,583 | 12,74 |
| н-Бутан | 34,72 | 26,08 | 0,545 | 39,22 |
| изо-Пентан | 26,69 | 26,84 | 0,574 | 11,61 |
| н-Пентан | 33,59 | 25,99 | 0,550 | 28,21 |
Энтальпия нефтяных паров и углеводородных газов с повышением давления снижается. Разность энтальпий при атмосферном и повышенном давлении 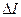 является функцией приведенных температуры и давления
является функцией приведенных температуры и давления 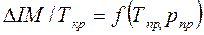 и определяется по графикам (рис.2.7). По известной поправке
и определяется по графикам (рис.2.7). По известной поправке 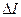 находится энтальпия при повышенном давлении
находится энтальпия при повышенном давлении 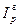 :
:
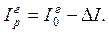
Энтальпия смеси газов или паров, как и теплоемкость, рассчитывается по правилу аддитивности.
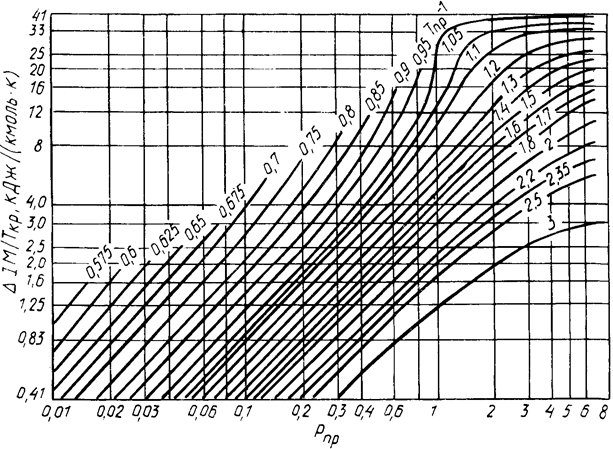
Рисунок 2.7 а – График для определения энтальпии нефтяных паров в узком интервале приведенных температуры и давления
Пользование диаграммой.От точки соответствующей заданному значению приведенного давления, провести вертикальную прямую до пересечения с кривой приведенной температуры. Через точку пересечения провести горизонтальную прямую до шкалы искомых значений изменения энтальпии.
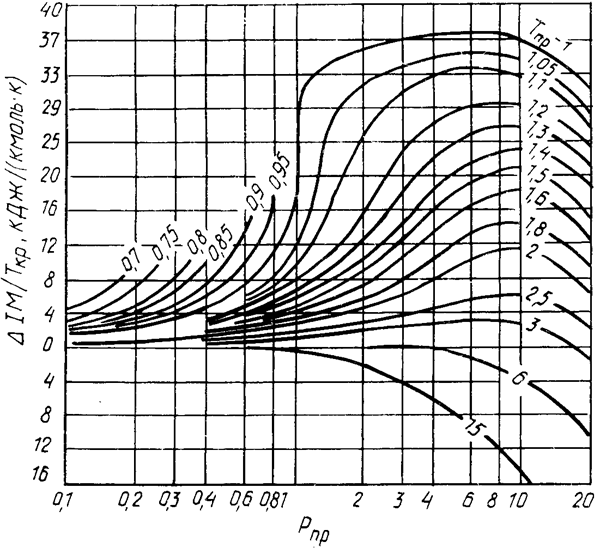
Рисунок 2.7 б – График для определения энтальпии нефтяных паров в широком интервале приведенных температуры и давления
Пользование диаграммой.От точки соответствующей заданному значению приведенного давления, провести вертикальную линию до пересечения с кривой соответствующей приведенной температуры. Через точку пересечения провести горизонтальную прямую до пересечения со шкалой искомых значений изменения энтальпии.
Дата добавления: 2017-11-21; просмотров: 4365;











