СЖИЖЕННЫЕ УГЛЕВОДОРОДНЫЕ ГАЗЫ
Теплота испарения. Теплота испарения, называемая также теплотой парообразования или энтальпией испарения, для многих газов является известной величиной. В табл.2.5 приведены значения удельной теплоты испарения индивидуальных углеводородов при нормальном давлении и температуре кипения и некоторые другие их характеристики.
Таблица 2.5 – Характеристика углеводородных газов
| Газы | Температура кипения, К | Удельная теплота испарения, кДж/кг | Удельный объем при нормальных условиях, м3/кг | Молярный объем при нормальных условиях, м3/кмоль |
| Метан | 111,6 | 518,1 | 1,39 | 22,38 |
| Этилен | 169,4 | 481,6 | 0,79 | 22,25 |
| Этан | 184,6 | 486,2 | 0,74 | 22,18 |
| Пропилен | 225,5 | 440,2 | 0,52 | 21,97 |
| Пропан | 231,1 | 425,9 | 0,49 | 21,64 |
| изо-Бутилен | 266,2 | 397,0 | 0,40 | 22,42 |
| изо-Бутан | 261,5 | 366,0 | 0,37 | 21,64 |
| н-Бутан | 272,7 | 387,8 | 0,37 | 21,46 |
| изо-Пентан | 301,1 | 342,6 | 0,29 | 21,03 |
| н-Пентан | 309,3 | 257,7 | 0,29 | 20,87 |
Повышение температуры приводит к уменьшению теплоты испарения, и в критическом состоянии, когда может существовать только паровая фаза, теплота испарения равна нулю. Используя данные табл.2.5, теплоту испарения Lт при любой температуре Т легко определить по формуле
Lт=bL0Т/Т0,
где b – температурная поправка; L0 – теплота испарения при нормальной температуре кипения (см. табл.2.5).
Температурная поправка b определяется по графику (рис.2.8) в зависимости от приведенной температуры и отношения Т0/Ткр.
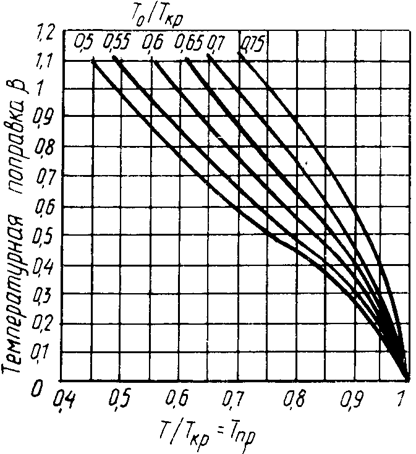
Рисунок 2.8 – График для определения температурной поправки к теплоте испарения
С ростом давления теплота испарения также уменьшается. Оценить это влияние можно по формуле Трутона
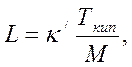 (2.11)
(2.11)
где Ткип – температура кипения углеводорода, К; k/ – постоянная, определяемая по графику (рис. 2.9) как функция отношения 0,0102р/Т; р – давление в системе, Па; Т – температура в системе, К.
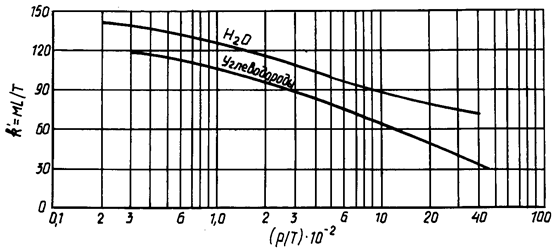
Рисунок 2.9 – График для определения постоянной k/ в формуле Трутона для расчета теплоты испарения
Формула Трутона дает возможность подсчитать теплоту испарения в килоджоулях на килограмм не только индивидуальных углеводородов, но и их смесей.
При работе со сжиженными газами важно знать объем газовой фазы Vг, получающийся при их испарении. Его определяют по формуле
Vг=NVм, (2.12)
где N – количество жидкой фазы, кмоль; Vм – молярный объем углеводорода (см. табл. 2.5), м3/кмоль.
Для технических сжиженных газов значение Vм принимается равным 21,6 м3/кмоль.
Объем паров, получаемый при испарении 1 м3 сжиженного газа, определяется

где rж – плотность жидкой фазы, кг/м3.
Если расчет ведется для смеси газов, необходимо использовать правило аддитивности.
Теплота сгорания. Теплотой сгорания называют количество теплоты, выделяемое при сжигании топлива. В СИ удельную теплоту сгорания измеряют в джоулях на килограмм и кратных единицах. В технологических расчетах используют иногда молярную (килоджоуль на киломоль) и объемную (килоджоуль на кубический метр) теплоту сгорания. Различают высшую и низшую теплоты сгорания. Первая учитывает теплоту, выделяемую дымовыми газами при их охлаждении, а также теплоту конденсации образующихся при сгорании водяных паров, вторая – нет. Другими словами, низшая теплота сгорания меньше высшей на величину указанной теплоты. На практике продукты сгорания обычно не охлаждаются до температуры конденсации водяных паров, поэтому в расчетах пользуются низшей теплотой сгорания 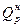 , рассчитанной на рабочий состав топлива. Численные значения теплот сгорания некоторых газов при нормальных условиях
, рассчитанной на рабочий состав топлива. Численные значения теплот сгорания некоторых газов при нормальных условиях 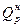 приведены в табл.2.6.
приведены в табл.2.6.
Таблица 2.6 – Низшая теплота сгорания 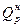 горючих газов
горючих газов
| Газы | Молярная, кДж/моль | Удельная, кДж/кг | Объемная, кДж/м3 |
| Метан | 800 931 | 49 933 | 35 756 |
| Этилен | 1 333 518 | 47 540 | 59 532 |
| Этан | 1 425 799 | 47 415 | 63 652 |
| Пропилен | 1 937 450 | 46 042 | 86 493 |
| Пропан | 2 041 491 | 46 302 | 91 138 |
| изо-Бутан | 2 648 361 | 47 208 | 118 230 |
| н-Бутан | 2 655 060 | 47 327 | 118 530 |
| изо-Пентан | 3 266 404 | 45 272 | 145 822 |
| н-Пентан | 327 401 | 45 383 | 146 178 |
| Водород | 241 159 | 119 622 | 10 766 |
| Оксид углерода | 283 577 | 10 124 | 12 660 |
| Сероводород | 525 142 | 15 408 | 23 444 |
Теплота сгорания смеси горючих газов 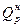 определяется по правилу аддитивности:
определяется по правилу аддитивности:
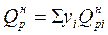 .
.
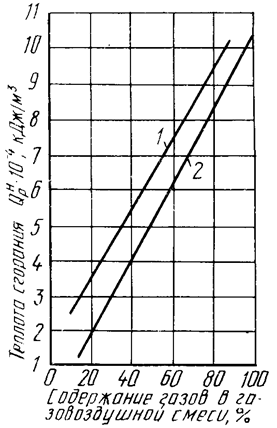
В практической работе часто используют смеси паров сжиженных углеводородных газов с воздухом. Теплоту сгорания таких пропано- и бутано-воздушных смесей можно определить по графику (рис.2.10).
|
Горение горючих газов. Для поддержания нормального горения газообразного или другого топлива необходим кислород или воздух. Теоретический объем VТ кислорода или воздуха рассчитанный по стехиометрическим уравнениям горения различных газов, приведен в табл.2.7.
Для смеси газов теоретических объем кислорода или воздуха подсчитывается по правилу аддитивности.
В промышленных условиях обычно используется воздух, реальное количество которого берется несколько больше теоретического, чтобы обеспечить наилучшую полноту сгорания. Отношение реального объема воздуха Vp к теоретическому называют коэффициентом избытка воздуха a=Vp/VТ. Коэффициент избытка воздуха для газообразного топлива принимают равным 1,05-1,2.
Объем и состав продуктов сгорания, образующихся при горении газов с теоретически необходимым объемом воздуха, приведены в табл.2.8.
Объемы воздуха и продуктов сгорания в табл.2.7 и 2.8 приведены для нормальных условий (101,3 кПа, 273 К). Если фактические условия горения отличаются от нормальных, объемы следует пересчитать по одному из законов состояния газа.
Таблица 2.7 – Теоретический объем кислорода и воздуха при сжигании 1 м3 газа, м3
| Газ | Кислород | Воздух | Газ | Кислород | Воздух |
| Метан | 2,0 | 9,53 | Бутаны | 6,5 | 30,90 |
| Этилен | 3,0 | 14,28 | Пентаны | 38,08 | |
| Этан | 3,5 | 16,66 | Водород | 0,5 | 2,38 |
| Пропилен | 4,5 | 21,42 | Оксид углерода | 0,5 | 2,38 |
| Пропан | 23,8 | Сероводород | 1,5 | 7,14 | |
| Бутилен | 28,56 |
Таблица 2.8 – Состав и объем продуктов сгорания, образующихся при горении 1 м3 газа, м3
| Газ | Диоксид углерода | Водяной пар | Азот | Всего продуктов сгорания | Максимальное содержание СО2, % |
| Метан | 7,50 | 10,50 | 11,8 | ||
| Этилен | 11,28 | 15,28 | 15,0 | ||
| Этан | 13,16 | 18,16 | 13,2 | ||
| Пропилен | 16,92 | 22,92 | 15,0 | ||
| Пропан | 18,80 | 25,80 | 13,8 | ||
| Бутилены | 22,56 | 30,56 | 15,0 | ||
| Бутаны | 22,40 | 33,40 | 14,0 | ||
| Пентаны | 30,08 | 41,08 | 15,0 | ||
| Водород | - | 1,88 | 2,88 | - | |
| Оксид углерода | - | 1,88 | 2,88 | 34,7 | |
| Сероводород | 5,64 | 7,64 | - |
В практике сжигания топлива используется понятие жаропроизводительной способности или жаропроизводительности, которая представляет собой температуру, развиваемую при полном сгорании топлива с теоретическим количеством воздуха без учета тепловых потерь и при начальной температуре топлива и воздуха 0°С (273 К).
Значения жаропроизводительности различных горючих газов приведены в табл.2.9. Для смеси газов жаропроизводительность (tmax, °С) определяется по формуле
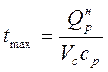 , (2.13)
, (2.13)
где 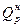 – объемная теплота сгорания смеси газов, кДж/м3; Vc – объем продуктов полного сгорания топлива с теоретически необходимым объемом воздуха, м3; ср – средняя теплоемкость продуктов сгорания, подсчитанная в интервале температур от °С до tmax, кДж/(м3×К).
– объемная теплота сгорания смеси газов, кДж/м3; Vc – объем продуктов полного сгорания топлива с теоретически необходимым объемом воздуха, м3; ср – средняя теплоемкость продуктов сгорания, подсчитанная в интервале температур от °С до tmax, кДж/(м3×К).
Знаменатель выражения (2.13) может быть подсчитан по правилу аддитивности.
Таблица 2.9 – Жаропроизводительность горючих газов
| Газ | Максимальное содержание СО2 при сжигании газа в воздухе, % | Жаропроизводительность, °С | Газ | Максимальное содержание СО2 при сжигании газа в воздухе, % | Жаропроизводительность, °С |
| Метан | 11,8 | Бутан | 14,0 | ||
| Этилен | 15,0 | Пентан | 14,2 | ||
| Этан | 13,2 | Водород | - | ||
| Пропилен | 15,0 | Оксид углерода | 34,7 | ||
| Пропан | 13,8 | Природный | 11,8 | ||
| Бутилен | 15,0 | Попутный | 13,0 |
ЛИТЕРАТУРА
1. Расчёты основных процессов и аппаратов нефтепереработки : Справочник/ Под ред. Е.Н.Судакова.-М.:Химия, 1979.-568с.
2. Сарданашвили А.Г., Львова А.И. Примеры и задачи по технологии переработки нефти и газа.-М.:Химия, 1980.-256с.
3. Эрих В.Н., Расина М.Г., Рудин М.Г. Химия и технология нефти и газа-Л..-Химия, 1985.-424с.
4. Кузнецов А.А., Судаков Е.Н.Расчёты основных процессов и аппаратов переработки углеводородных газов: Справ, пособие.-М.:Химия, 1983-.224с.
5. Варгафтик Н.Б.Справочник по теплофизическим свойствам газов и жидкостей.-М.: Наука, 1972.-720с.
6. Технологические расчёты установок переработки нефти:Учеб. пособие для вузов/ Танатаров М.А., Ахметшина М.Н., Фасхутдинов Р.А. и др.-М.:Химия, 1987.-352с.
7. Рудин М.Г., Смирнов Г.Ф. Проектирование нефтеперерабатывающих и нефтехимических заводов .-Л.: Химия, 1984.-256с.
8. Рудин М.Г., Драбкин А.Е. Краткий справочник нефтепереработчика.-Л. Химия, 198О.-328с.
9. Справочник нефтепереработчика: Справочник/ Под ред. Г.А.Ластовкина, Е.Д.Радченко и М.Г. Рудина.-Л.: Химия, 198б.-648с
10. Хорошко С.И., Хорошко А.Н. Сборник задач по химии и технологии нефти и газа : Учеб. пособие для сред. спец. учеб. заведений.-Минск :Высш.шк., 1989.-122с.
11. Рябцев Н.И. Природные и искусственные газы.-М.:Стройиздат, 1978.-325с.
Дата добавления: 2017-11-21; просмотров: 5448;











