Примеры выполнения заданий
Пример 1. Укажите а) заряды комплексообразователя, лигандов и комплексного иона, б) координационное число комплексообразователя, в) названия соединений: 1) [Ni(NH3)4]SO4, 2) [Cr(NH3)5(CNS)](NO3)2, 3) H2[PtCl6], 4) K2[Hg(CN)3(CNS)], 5) [Pt(NH3)2Cl4], 6) [Fe(NO)2(CO)2].
Решение
1) [Ni(NH3)4]SO4 – сульфат тетраамминникеля (II); SO42– – анион внешней сферы (по заряду и числу ионов внешней сферы определяют заряд комплексного иона); [Ni(NH3)4]2+ – комплексный катион; NH30 – лиганд; Ni2+ – катион-комплексообразователь, его координационное число равно 4.
2) [Cr(NH3)5(CNS)](NO3)2 – нитрат тиоцианатопентаамминхрома (III); [Cr(NH3)5(CNS)]2+ – комплексный катион; NH30 и CNS– – лиганды; Cr3+ – ион-комплексообразователь, его координационное число равно 6.
3) H2[PtCl6] – гексахлороплатинат (IV) водорода; [PtCl6]2– – комплексный анион; Cl– – лиганд; Pt4+ – ион-комплексообразователь, его координационное число равно 6.
4) K2[Hg(CN)3(CNS)] – трицианотиоцианатомеркурат (II) калия (меркуратами называют анионные комплексы ртути: mercurius – латинское название ртути, принятое у алхимиков); [Hg(CN)3(CNS)]2– – комплексный анион; Hg2+ – ион-комплексообразователь, его координационное число равно 4; CN– и CNS– – лиганды.
5) [Pt(NH3)2Cl4] – тетрахлородиамминплатина (IV); комплексное соединение без внешней сферы содержит электронейтральный комплекс; Pt4+ – ион-комплексообразователь с координационным числом 6; NH30 и Cl– – лиганды.
6) [Fe(NO)2(CO)2] – дикарбонилдинитрозилжелезо (0); Fe0 – атом-комплексообразователь с координационным числом 4; лиганды – молекулы NO и CO.
Пример 2.Приведите уравнения диссоциации соединений, напишите выражение константы нестойкости комплексного иона: [Hg(NH3)4](NO3)2, K2[Hg(CNS)4].
Решение
[Hg(NH3)4](NO3)2 = [Hg(NH3)4]2+ + 2NO3– (сильный электролит).
[Hg(NH3)4]2+ D Hg2+ + 4NH3
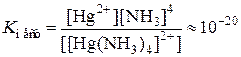
K2[Hg(CNS)4] = 2K+ + [Hg(CNS)4]2–
[Hg(CNS)4]2– D Hg2+ + 4CNS–
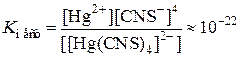
Пример 3. Опишите характер связей и пространственное строение комплексного иона в соединении K3[CoF6].
Решение
У иона Co3+ на внешней оболочке имеются вакантные 4s-, 4p- и 4d-орбитали:
Co3+ – 3d64s04p04d0
| 3d | 4s | 4p | 4d | ||||||||||
| ¯ | ¯ | ¯ | ¯ | ¯ |
Фторид-ионы имеют неподеленные пары электронов: 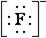 .
.
При взаимодействии F– и Co3+ образуется комплексный ион [CoF6]3–, в котором шесть лигандов F– образуют шесть ковалентных связей по донорно-акцеторному механизму:
| 3d | 4s | 4p | 4d | ||||||||||
| ¯ | ¯ | ¯ | ¯ | ¯ | ¯ | ¯ | ¯ | ¯ | ¯ | ¯ | |||
| F– | F– | F– | F– | F– | F– |
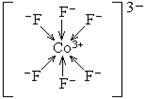
Как видно, при образовании комплекса происходит sp3d2-гибридизация и соответственно полученный комплекс имеет октаэдрическую структуру.
Связи, образующиеся между внешней и внутренней сферой – ионные.
Пример 4.Составьте молекулярные и ионные уравнения возможных процессов, объясните их направленность, подпишите названия комплексных соединений:
а) Na[Ag(NO2)2] + K2S ® б) K2[CdCl4] + Hg(NO3)2 ®
в) K2[HgBr4] + KCN ® г) [Ag(NH3)2]Cl + HNO3 ®
д) Co(OH)3 + KCN® е) K4[Fe(CN)6] + CuCl2 →
ж) [Ag(NH3)2]Cl + NaNO3 ®
Решение
Протекание обменных реакций, в которых участвуют комплексные ионы, подчиняется общему правилу обменных процессов: они идут в сторону более полного связывания ионов. Это достигается при образовании труднорастворимых веществ с низкими значениями ПР или слабых электролитов (в частности, комплексных ионов) с низкими значениями Kдис (Kнест комплексных ионов).
а) 2Na[Ag(NO2)2] + K2S = Ag2S¯ + 2NaNO2 + 2KNO2
динитритоаргентат (I) натрия
2[Ag (NO2)2]– +S2– = Ag2S¯ + 4NO2–
Kнест » 10–3 ПР » 10–50
ПР образующегося вещества Ag2S значительно ниже Kнест исходного комплексного иона, ион-комплексообразователь связывается сульфид-ионами в осадок сульфида серебра, над которым концентрация ионов серебра меньше, чем в исходном растворе.
б) K2[CdCl4] + Hg(NO3)2 = K2[HgCl4] + Cd(NO3)2
тетрахлорокадмат тетрахлоромеркурат(II)
калия калия
[CdCl4]2– + Hg2+ = [HgCl4]2– + Cd2+
Kн » 10–3 > Kн » 10–15
В этой реакции исходный комплексный ион разрушается, превращаясь в новый, более прочный (произошла замена комплексообразователя – катиона кадмия на катион ртути).
в) В следующей реакции исходный комплексный ион превращается в более прочный путем замены лигандов:
K2[HgBr4] + 4KCN = K2[Hg(CN)4] + 4KBr
тетрабромoмеркурат (II) тетрацианомеркурат (II)
калия калия
[HgBr4]2– + 4CN– = [Hg(CN)]2– + 4Br–
Kн » 10–21 > Kн » 10–42
г) [Ag(NH3)2]Cl + HNO3 = NH4NO3 +AgCl
хлорид диамминсеребра (I) нитрат аммония
[Ag(NH3)2]+ + Cl- + H+ =NH4+ + AgCl¯
Kн » 10–8 Kн » 10–10, ПР » 10–10
Исходный комплексный ион разрушается, т.к. его лиганды (молекулы аммиака) образуют с ионами водорода более прочный комплекс – ион аммония, а ион-комплексообразователь образует осадок хлорида серебра.
д) Co(OH)3 + 6KCN = K3[Co(CN)6] + 3KOH
гексацианокобальтат (III) калия
Co(OH)3 + 6CN– = [Co(CN)6]3– + 3OH–
ПР = 2,5×10–37 Kн » 10–64
Реакция идет в сторону образования очень прочного комплексного иона, поэтому осадок гидроксида кобальта растворяется.
е) K4[Fe(CN)6] + 2CuCl2 = Cu2[Fe(CN)6]¯ + 4KCl
гексацианоферрат (II) гексацианоферрат (II)
калия меди (II)
[Fe(CN)6]4- + 2Cu2+ = Cu2[Fe(CN)6]¯
В этой реакции комплексный ион не разрушается, он образует нерастворимое соединение с ионами меди.
ж) [Ag(NH3)2]Cl + NaNO3 D [Ag(NH3)2]NO3 + NaCl
хлорид диамминсеребра нитрат диамминсеребра
[Ag(NH3)2]+ + Cl– + Na+ + NO3– D [Ag(NH3)2]+ + NO3– + Na+ + Cl–
Данная реакция обратима, не идет до конца.
Дата добавления: 2017-11-21; просмотров: 2343;











