Свойства соединений d-металлов
Марганец, проявляя в соединениях степени окисления +2, +3, +4, +6 и +7, образует следующие оксиды, соответствующие им гидроксиды и соли:
| +2 MnO | +3 Mn2O3 | +4 MnO2 | +6 MnO3 | +7 Mn2O7 |
| Mn(OH)2 | Mn(OH)3 | Mn(OH)4 | H2MnO4 | HMnO4 |

| 
| 
| ||
| основные | амфотерные | кислотные | ||
| MnSO4 | Mn2(SO4)3 | Mn(NO3)4 Na4MnO4 | K2MnO4 | KMnO4 |
Кислотно-основные свойства этих соединений изменяются с ростом степени окисления от основных через амфотерные к кислотным. Причина такого изменения свойств объясняется изменением сравнительной прочности связей Ме–О и О–Н. С увеличением степени окисления металла и уменьшением его радиуса происходит упрочнение связи Me–О и ослабление связи О–Н.
Окислительно-восстановительные свойства соединений d-металлов также изменяются с повышением степени окисления. Соединения d-металлов в высшей степени окисления проявляют только окислительные свойства:
2KMnO4 + 10KI + 8H2SO4 = 2MnSO4 + 5I2 + 6K2SO4 + 8H2O,
окислитель – KMnО4.
Соединения, содержащие d-элемент в промежуточной степени окисления, могут проявлять как окислительные, так и восстановительные свойства:
MnO2 + 2KI + 2H2SO4 = MnSO4 + I2 + K2SO4 + 2H2O,
окислитель – MnO2.
MnO2 + NaBiO3 + HNO3 → HMnO4 + BiONO3 + NaNO3 + H2O,
| MnO2 + 2H2O –3ē → MnO4– + 4H+ | ||||
| NaBiO3 + 4H+ +2ē → BiO+ + Na+ + 2H2O | ||||
| 2MnO2 + 4H2O + 3NaBiO3 + 12Н+ → 2МnО4– +8H+ + 3BiO+ + 3Na+ + 6H2O 2MnO2 + 3NaBiO3 + 6HNO3 = 2HMnO4 + 3BiONO3 + 3NaNO3 + 2H2O | ||||
Восстановитель – MnO2.
У соединений, содержащих d-элемент в низшей положительной степени окисления (+1, +2), преобладают восстановительные свойства, например, гидроксид железа (II) легко окисляется на воздухе:
4Fe(OH)2 + О2 + 2Н2О = 4Fe(OH)3
| Fe(OH)2 + OH– –ē → Fe(OH)3 | ||
| O2 + 2H2O +4ē → 4OH– | ||
| 4Fe(OH)2 + О2 + 2Н2О = 4Fe(OH)3 |
Восстановитель – Fe(OH)2.
Некоторые соединения d-элементов в промежуточной степени окисления способны к диспропорционированию (самоокислению-самовосстановлению).
3K2МnO4 + 2Н2О = 2KMnO4 + MnO2 + 4KOH
| MnO42– –ē → MnO4– | ||
| MnO42– + 2H2O +2ē → MnO2 + 4OH– | ||
| 3MnO42– + 2H2O = 2 MnO4– + MnO2 + 4OH– |
Окислительно-восстановительные свойства соединений d-элементов зависят от их устойчивости. С повышением устойчивости соединений в высшей степени окисления их окислительные свойства ослабевают:
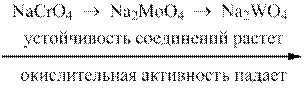
Особым свойством d-элементов является их способность к комплексообразованию.
Контрольные вопросы
1. Опишите особенности электронного строения металлов побочных подгрупп.
2. Опишите общие физические свойства d-элементов.
3. Охарактеризуйте окислительно-восстановительные свойства соединений d-металлов в различных степенях окисления.
4. Проанализируйте изменение прочности связи Mn–O в оксидах: MnO, Mn2O3, MnO2, Mn2O7.
4. Охарактеризуйте изменение кислотно-основных свойств соединений d-металлов с повышением степени окисления элемента.
5. Рассмотрите способы получения d-металлов.
Дата добавления: 2017-11-21; просмотров: 1425;











