Электролиз расплавов
При электролизе расплавов солей на катоде восстанавливаются ионы металлов, на аноде – окисляются ионы неметаллов:
В расплаве соль диссоциирует на ионы: ScCl3 → Sc3+ + 3Cl–.
Ионы разряжаются на электродах: катионы – на катоде, анионы – на аноде:
| K(–) | Sc3+ +3ē → Sc0 | ||
| A(+) | 2Cl– –2ē → Cl2 | ||
| 2ScCl3 → 2Sc + 3Cl2 |
Электролиз расторов
Присутствие воды – особенность электролиза растворов, поскольку вода может подвергаться электролизу.
На катоде восстанавливаются ионы водорода и металлов из раствора или водород из воды, причем порядок восстановления определяется следующими правилами:
1) Восстанавливаются катионы в порядке уменьшения их стандартного электродного потенциала.
2) Катионы металлов с положительным значением стандартного электродного потенциала полностью восстанавливаются на катоде с образованием свободного металла.
3) Катионы металлов от Mn – до H в нейтральной среде восстанавливаются параллельно с водородом воды из-за высокого перенапряжения водорода. Перенапряжение водорода – смещение потенциала восстановления водорода к более отрицательным значениям вследствие замедленного разряда ионов водорода. В кислой среде преимущественно восстанавливается водород.
4) Катионы, потенциал восстановления которых в кислой среде меньше нуля или в нейтральной меньше –0,41 В, восстановить из растворов нельзя, т.к. идет восстановление ионов водорода или воды:
2H2O +2ē ® H2 + 2OH–.
Таблица 9.2
Последовательность разрядки ионов металлов на катоде при электролизе растворов солейв в нейтральной среде
| Li Rb K Ba Ca Na Mg Al | Mn Zn Cr Fe Co Pb H | Cu Hg Ag Pt Au |
| Восстанавливается только водород из воды | Восстанавливается металл и частично водород из воды | Восстанавливается металл |
Анод электролизера может быть инертным, не изменяющимся в процессе электролиза (C, Pt), или активным.
На инертных анодах:
1) окисляются простые анионы в порядке повышения их потенциала: S2– (E° = 0,17 В), I– (E° = 0,536 В), Br– (E° = 1,065 В), Cl– (E° = 1,359 В);
2) при отсутствии простых анионов окисляется молекула воды:
2Н2О –4ē → О2 + 4Н+.
3) Кислородсодержащие анионы (SO42–, NO3–, PO43–, CO32–) в водных растворах, как правило, не окисляются.
Однако в концентрированных растворах анионы кислородсодержащих кислот (SO42–, NO3– и др.) могут при разрядке отдавать кислород или перестраиваться. Например, электролиз концентрированного раствора H2SO4 приводит к образованию надсерной кислоты на аноде:
2H2SO4 –2ē → H2S2O8 + 2H+, E° = +2,01 B.
Рассмотрим электролиз сульфата цинка, который диссоциирует в растворе на ионы цинка и сульфат-ионы. Из-за перенапряжения водорода ионы цинка могут восстанавливаться из раствора на катоде. Кислородсодержащие ионы SO42– не будут окисляться на аноде. На аноде будут окисляться молекулы воды с выделением газообразного кислорода. В прианодном пространстве будут накапливаться ионы водорода, рН раствора возле анода будет понижаться.
ZnSO4 ® Zn2+ + SO42–
| K(–) | Zn2+ + 2ē = Zn | ||
| A(+) | 2Н2О –4ē = О2 + 4Н+. | ||
| 2ZnSO4 + 2H2O ® 2Zn + O2 + 2H2SO4 |
При электролизе с активным анодом растворяется металл анода:
Ме –nē → Меn+.
Процесс сводится к переносу металла с анода на катод. Такие аноды делают из неочищенной меди при ее рафинировании, из никеля и хрома при нанесении покрытий из этих металлов на различные изделия.
Таким образом, характер и течение электродных процессов при электролизе может зависить не только от состава электролита, но и его концентрации, природы электродов, кислотности среды, присутствия ионов–комплексообразователей, плотности тока и других факторов.
Законы электролиза
В 1833 г. английский ученый М. Фарадей (1791-1867 гг.) открыл законы, определяющие зависимость между количеством прошедшего электричества и количеством вещества, испытавшего химические превращения на электроде.
С учетом современной терминологии законы Фарадея можно записать в следующем виде:
1. Количество вещества, испытавшего электрохимические превращения на электроде, прямо пропорционально количеству прошедшего электричества.
2. Массы прореагировавших на электродах веществ при постоянном количестве электричества относятся друг к другу как молярные массы их эквивалентов.
Масса металла, осаждающегося на катоде, рассчитывается по формуле:
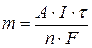
| (9.9) |
где А – молярная масса металла, г/моль; I – сила тока, А; t – время, с; F – число Фарадея, 96500 Кл; n – число электронов, принимающих участие в электродной реакции;  – количество электричества, А·с;
– количество электричества, А·с;  – молярная масса окислительно-восстановительного эквивалента, г/моль-экв;
– молярная масса окислительно-восстановительного эквивалента, г/моль-экв; 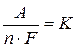 – электрохимический эквивалент, г/Кл.
– электрохимический эквивалент, г/Кл.
Таким образом, зная количество вещества, испытывающего превращения на электроде, можно рассчитать теоретическое количество электричества, которое должно пройти через электрохимическую ячейку. На этом основан электрохимический метод анализа – кулонометрия.
Дата добавления: 2017-11-21; просмотров: 2281;











