Атомные и молекулярные кристаллы
В твердом агрегатном состоянии у веществ могут образоваться не только ионные, но также молекулярные и атомные кристаллические решетки.
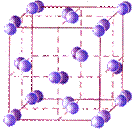 кристаллическая решетка иода кристаллическая решетка иода
| Так, твердый иод имеют молекулярную кристаллическую решетку, в узлах которых находятся молекулы I2. Аналогичным образом построена кристаллическая решетка твердого диоксида углерода (сухой лед) - в узлах кристаллической решетки находятся молекулы CO2. |
Алмаз и графит - кристаллы с атомной решеткой, имеющей в узлах атомы углерода с разным расположением этих узлов в пространстве.
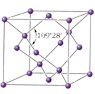 кристаллическая решетка алмаза кристаллическая решетка алмаза
| 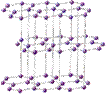 кристаллическая решетка графита кристаллическая решетка графита
|
Водородная связь.
При изучении многих веществ были обнаружены так называемые водородные связи. Например, молекулы HF в жидком фтороводороде связаны между собой водородной связью, аналогично связаны молекулы Н2О в жидкой воде или в кристалле льда, а также молекулы NH3 и Н2О между собой в межмолекулярном соединении - гидрате аммиака NH3 · Н2О.
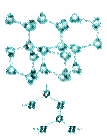 водородные связи между молекулами воды водородные связи между молекулами воды
| Водородная связь образуется за счёт сил электростатического притяжения водородсодержащих полярных молекул, содержащих атомы наиболее электроотрицательных элементов - F, O, N. Например, водородные связи имеются в HF, Н2О, NH3, но их нет в HCl, Н2S, PH3. |
Водородные связи малоустойчивы и разрушаются довольно легко (например, при плавлении льда, кипении воды). Однако на разрыв этих связей затрачивается некоторая дополнительная энергия, и поэтому температуры плавления и кипения веществ с водородными связями между молекулами оказываются значительно выше, чем у подобных веществ, но без водородных связей:
| Вещество | Температура плавления | Температура кипения | |
| HF | −83,36 °C | +19,52 °C | |
| HCl | −114,00 °C | −85,08 °C | |
| H2O | 0,00 °C | +100,00 °C | |
| H2S | −8,54 °C | −60,35 °C | |
Валентность. Донорно-акцепторные связи.Согласно теории молекулярного строения, атомы могут образовывать столько ковалентных связей, сколько орбиталей у них занято одним электроном, однако так бывает не всегда. [В принятой схеме заполнения АО вначале указывают номер оболочки, затем тип орбитали и далее, если на орбитали находится более одного электрона, – их число (верхний индекс). Так, запись (2s)2 означает, что на s-орбитали второй оболочки находятся два электрона.] Атом углерода в основном состоянии (3Р) имеет электронную конфигурацию (1s)2(2s)2(2px)(2py), при этом две орбитали не заполнены, т.е. содержат по одному электрону. Однако соединения двухвалентного углерода встречаются очень редко и обладают высокой химической активностью. Обычно углерод четырехвалентен, и связано это с тем, что для его перехода в возбужденное 5S-состояние (1s)2(2s) (2px)(2py)(2pz) с четырьмя незаполненными орбиталями нужно совсем немного энергии. Энергетические затраты, связанные с переходом 2s-электрона на свободную 2р-орбиталь, с избытком компенсируются энергией, выделяющейся при образовании двух дополнительных связей. Для образования незаполненных АО необходимо, чтобы этот процесс был энергетически выгодным. Атом азота с электронной конфигурацией (1s)2(2s)2(2px)(2py)(2pz) не образует пятивалентных соединений, поскольку энергия, необходимая для перевода 2s-электрона на 3d-орбиталь с образованием пятивалентной конфигурации (1s)2(2s)(2px)(2py)(2pz)(3d), слишком велика. Аналогичным образом, атомы бора с обычной конфигурацией (1s)2(2s)2(2p) могут образовывать трехвалентные соединения, находясь в возбужденном состоянии (1s)2(2s)(2px)(2py), которое возникает при переходе 2s-электрона на 2р-АО, но не образует пятивалентных соединений, поскольку переход в возбужденное состояние (1s)(2s)(2px)(2py)(2pz), обусловленный переводом одного из 1s-электронов на более высокий уровень, требует слишком много энергии. Взаимодействие атомов с образованием связи между ними происходит только при наличии орбиталей с близкими энергиями, т.е. орбиталей с одинаковым главным квантовым числом. Соответствующие данные для первых 10 элементов периодической системы суммированы ниже. Под валентным состоянием атома понимают состояние, в котором он образует химические связи, например состояние 5S для четырехвалентного углерода.
| ВАЛЕНТНЫЕ СОСТОЯНИЯ И ВАЛЕНТНОСТИ ПЕРВЫХ ДЕСЯТИ ЭЛЕМЕНТОВ ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ | |||
| Элемент | Основное состояние | Обычное валентное состояние | Обычная валентность |
| H | (1s) | (1s) | |
| He | (1s)2 | (1s)2 | |
| Li | (1s)2(2s) | (1s)2(2s) | |
| Be | (1s)2(2s)2 | (1s)2(2s)(2p) | |
| B | (1s)2(2s)2(2p) | (1s)2(2s)(2px)(2py) | |
| C | (1s)2(2s)2(2px)(2py) | (1s)2(2s)(2px)(2py)(2pz) | |
| N | (1s)2(2s)2(2px)(2py)(2pz) | (1s)2(2s)2(2px)(2py)(2pz) | |
| O | (1s)2(2s)2(2px)2(2py)(2pz) | (1s)2(2s)2(2px)2(2py)(2pz) | |
| F | (1s)2(2s)2(2px)2(2py)2(2pz) | (1s)2(2s)2(2px)2(2py)2(2pz) | |
| Ne | (1s)2(2s)2(2px)2(2py)2(2pz)2 | (1s)2(2s)2(2px)2(2py)2(2pz)2 |
Указанные закономерности проявляются в следующих примерах:
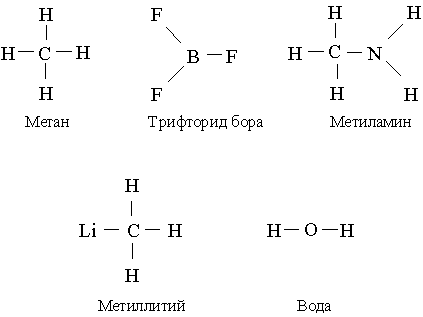
Дата добавления: 2017-09-01; просмотров: 1573;











