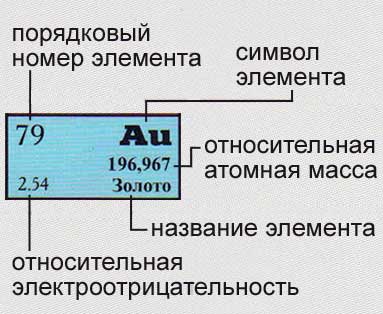
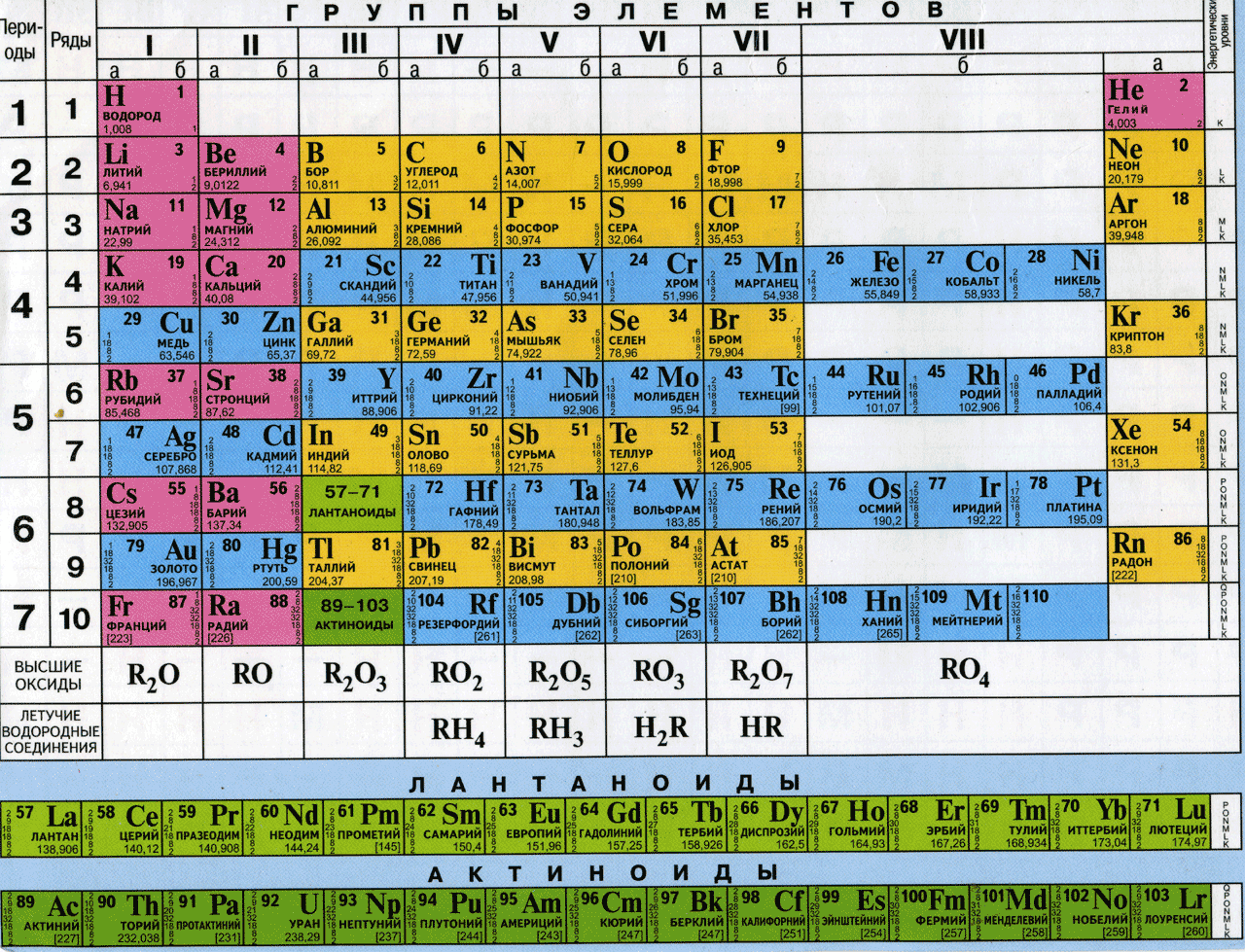
Периодическая система элементов Менделеева (1869 г.)
Периодическая система элементов объясняется принципом Паули, который и лежит в основе систематики заполнения электронных состояний в атомах. Поскольку порядковый номер Z химического элемента равен общему числу электронов в атоме данного элемента каждый последующий элемент можно «образовать» из предыдущего прибавлением к ядру одного протона (соответственно прибавлением одного электрона в электронной оболочке атома). С увеличением числа электронов каждый следующий электрон занимает возможное энергетическое состояние с наименьшей энергией; заполнение электронами энергетических состояний происходит в соответствии с принципом Паули.
Периоды – горизонтальные строки химических элементов.
Группы – вертикальные столбцы химических элементов.
Подгруппы – А - главные (s- и р-элементы) и В - побочные (d- и f-элементы).
Номер периода – номер внешнего энергетического уровня в электронной формуле атома элемента.
Номер группы (для большинства элементов) – общее число валентных электронов (электронов внешнего энергетического уровня, а также предпоследнего d-подуровня, если он застроен не полностью).
| Число элементов в периоде – максимальная емкость соответствующего энергетического уровня: 1 период – 2 элемента (1s2) 2 период – 8 элементов (2s22p6) 3 период – 8 элементов (3s23p6) 4 период – 18 элементов (4s23d104p6) 5 период – 18 элементов (5s24d105p6) 6 период – 32 элемента (6s24f145d106p6) 7 период – не завершен | |
Построение периодов – в начале: два s-элемента, в конце: шесть р- элементов. В четвертом и пятом периодах между ними помещается по десять d-элементов, а в шестом и седьмом к ним добавляются четырнадцать f-элементов (формы электронных орбиталей).
В периоде – свойства химических элементов различаются между собой, т.к. электронные конфигурации валентных электронов их атомов различны.
В подгруппе – свойства элементов сходны между собой, т.к. электронные конфигурации валентных электронов их атомов сходны.
Причина периодичности свойств химических элементов заключается в периодической повторяемости сходных электронных конфигураций внешних энергетических уровней.
Формы электронных орбиталей (электронные семейства)
Классификация химических элементов по электронным конфигурациям их атомов (электронные орбитали):
| название семейства | Тип конфигурации | Застраиваемые подуровни |
| s - элементы | ns1–2 | внешний (n) s-подуровень |
| p -элементы | ns2 np1–6 | внешний (n) р-подуровень |
| d - элементы | (n-1)d1–10 ns1–2 | предвнешний (n–1 ) d-подуровень |
| f - элементы | (n-2)f1–14 (n-1)d1–10 ns1–2 | третий снаружи (n–2) f-подуровень |
Дата добавления: 2017-11-21; просмотров: 1320;











