Принцип Паули. Распределение электронов в атоме по состояниям
Состояние электрона в атоме однозначно описывается любым набором четырех независимых квантовых чисел: главного n, орбитального l, магнитного ml, магнитного спинового ms :
| Квантовое число | Принимаемые значения |
| Главное | n=1,2,3, … |
| Орбитальное | l=0,1,2, …, n-1 |
| Магнитное | 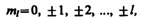
|
| Магнитное спиновое | ms=-1/2, +1/2 |
Формулировка принципа Паули:
В одном и том же атоме не может быть более одного электрона с одинаковым набором четырех квантовых чисел n,l,m1 и ms, т.е. Z(n,l,ml,ms)= 0 или 1. (Z(n,l,ml,ms) - число электронов, находящихся в квантовом состоянии, описываемом набором четырех квантовых чисел: n,l,ml,ms)
Согласно принципу Паули, два электрона в одном и том же атоме различаются значениями по крайней мере одного квантового числа.
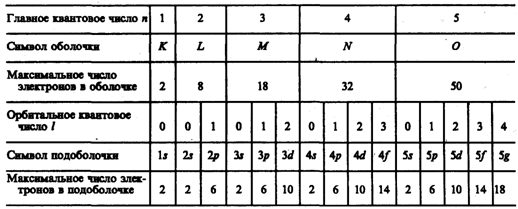
Распределение электронов по оболочкам и подоболочкам
Максимальное число электронов в состоянии, определяемом главным квантовым числом n:
Z (n) = 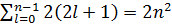
Электронная оболочка-совокупность электронов в многоэлектронном атоме, имеющих одно и то же главное квантовое число n.
Подоболочка-совокупность электронов в каждой из оболочек, соответствующих данному значению l.
Число подоболочек равно порядковому номеру n оболочки (l=0,1, …, n-1; всего n значений).
Число электронов в подоболочке определяется ml и ms; максимальное число электронов в подоболочке с данными магнитным и магнитным спиновым числами - орбитальным числом l равно 2(2l+1).
Таблица – число электронов в подоболочке
Дата добавления: 2017-11-21; просмотров: 1933;











